-薬物動態-
◆薬物動態
1.血漿中濃度
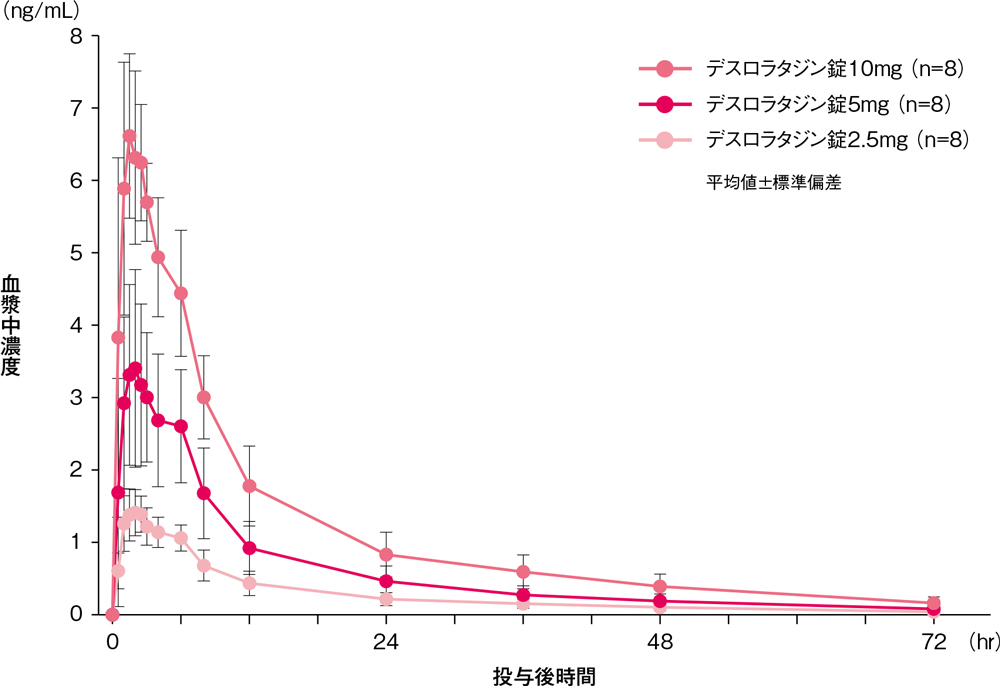
単回投与1)
健康成人男性にデスロラタジン錠2.5、5及び10mg(各8例)を空腹時単回経口投与したとき、血漿中デスロラタジン濃度は以下のとおりでした。
単回経口投与時の血漿中デスロラタジン濃度の推移
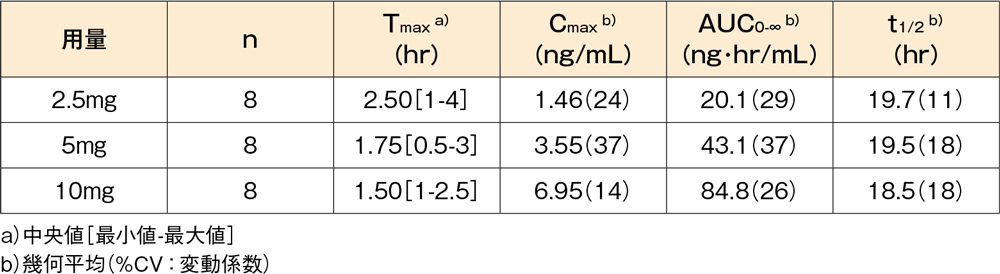
血漿中デスロラタジン濃度の薬物動態パラメータ
6.用法及び用量
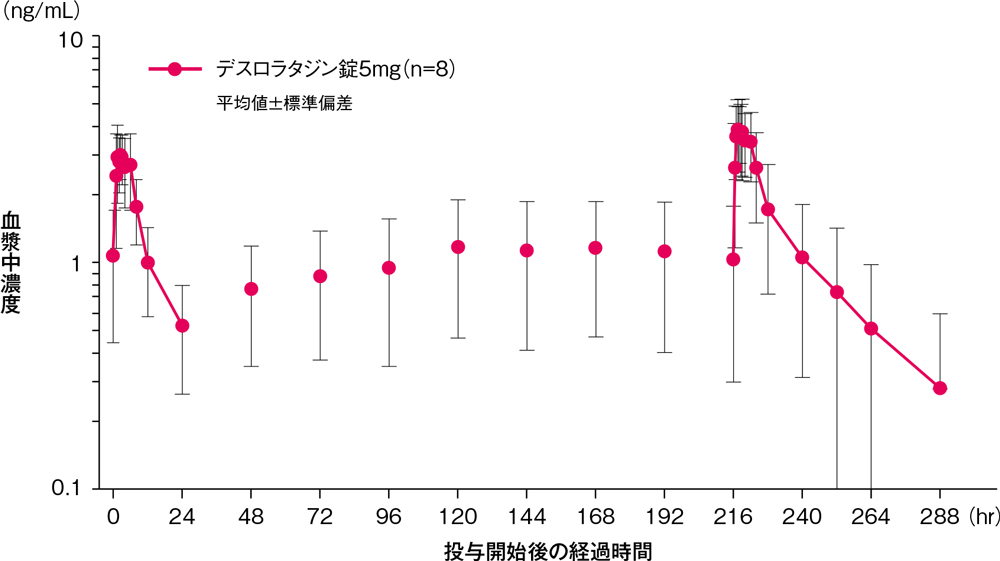
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。反復投与1)
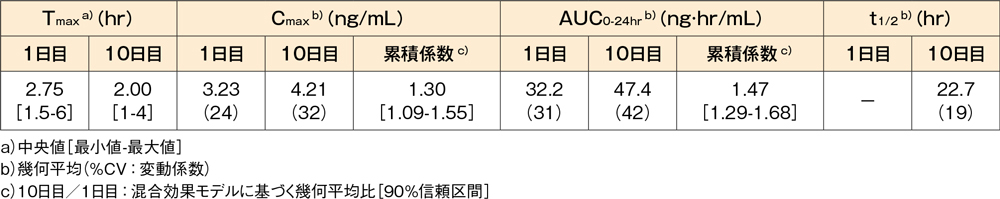
健康成人男性(8例)にデスロラタジン錠5mgを空腹時に1日1回10日間反復経口投与したとき、血漿中デスロラタジン濃度は投与開始後5日目までに定常状態に到達し、Cmax及びAUC0-24hrについて算出した累積係数はそれぞれ1.30及び1.47でした。
反復投与時の血漿中デスロラタジン濃度の推移
血漿中デスロラタジンの薬物動態パラメータ
食事の影響(単回投与)(外国人データ)2,3)
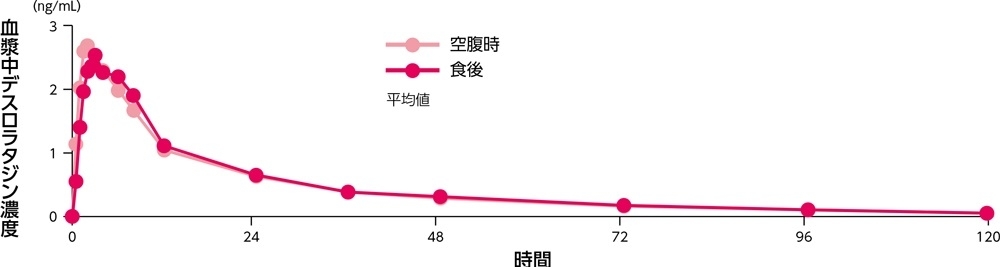
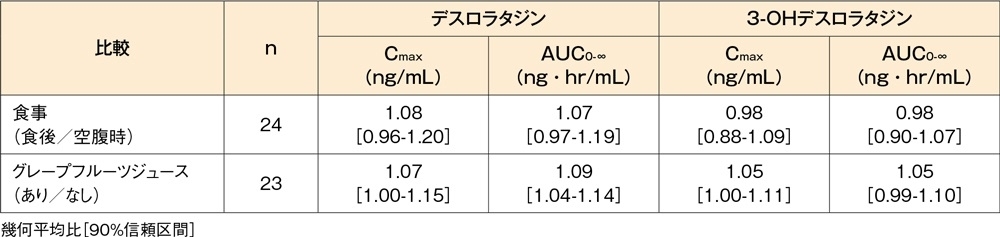
食後(高脂肪高カロリー食)に健康成人(24例)にデスロラタジン錠5mgを単回経口投与したとき、血漿中デスロラタジン及び3-OHデスロラタジン濃度(Cmax及びAUC)への影響は、空腹時投与群と比較し、いずれも認められませんでした。また、グレープフルーツジュース摂取後に健康成人(23例)にデスロラタジン錠5mgを単回経口投与したとき、血漿中デスロラタジン及び3-OHデスロラタジン濃度(Cmax及びAUC)への影響は、グレープフルーツジュース非摂取時と比較し、いずれも認められませんでした。
食後又は空腹時投与における血漿中デスロラタジン濃度の推移
食事及びグレープフルーツジュースの影響
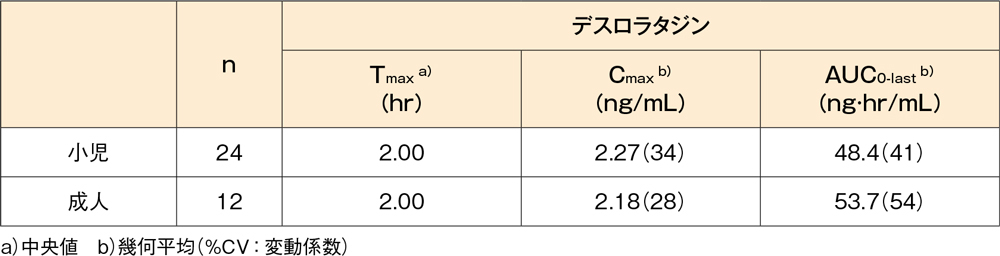
小児(外国人データ)4)
健康な小児(24例、年齢:12~17歳)及び成人(12例、年齢:18~45歳)に、デスロラタジン錠5mgを単回経口投与した結果、血漿中デスロラタジン濃度はいずれも投与後2時間(Tmaxの中央値)に最高値を示しました。また、小児及び成人における血漿中デスロラタジン濃度のCmaxはそれぞれ2.27及び2.18ng/mL、AUC0-lastはそれぞれ48.4及び53.7ng·hr/mLでした。
健康小児及び健康成人にデスロラタジン錠5mgを単回経口投与したときの
血漿中デスロラタジンの薬物動態パラメータ
9.特定の背景を有する患者に関する注意
- 9.7
-
小児等
国内において、低出生体重児、新生児、乳児、幼児及び12歳未満の小児を対象とした臨床試験は実施していない。
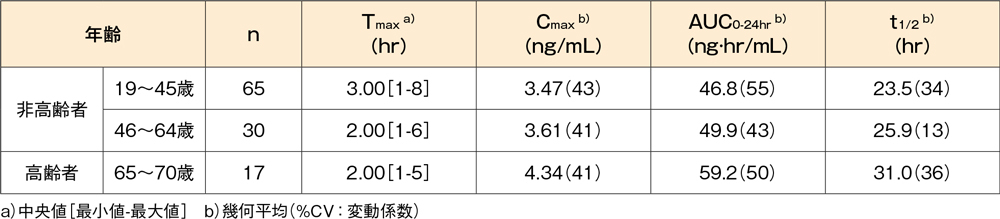
高齢者(外国人データ)5)
健康な高齢者(17例、年齢:65~70歳)にデスロラタジン錠5mgを1日1回10日間反復経口投与したとき、血漿中デスロラタジン濃度のCmax及びAUCは、非高齢対照(95例、年齢:19~64歳)と比較していずれも約20%上昇しました。高齢者でのデスロラタジンのt1/2は平均31.0時間(幾何平均)であり、非高齢対照群と比較して約30%延長しました。
健康成人にデスロラタジン錠5mgを1日1回10日間反復投与したときの10日目における年齢ごとの
デスロラタジンの薬物動態パラメータ
9.特定の背景を有する患者に関する注意
- 9.8
-
高齢者
一般に生理機能が低下している。
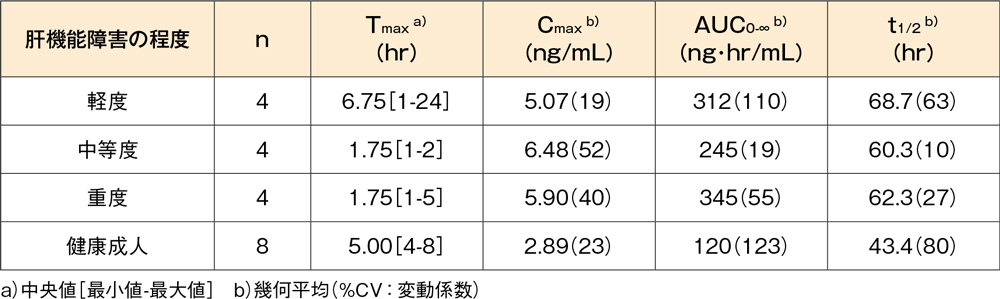
肝機能障害患者(外国人データ)6)
軽度(Child-Pughスコア:5~6)、中等度(Child-Pughスコア:7~9)又は重度(Child-Pughスコア:10~15)の慢性肝機能障害患者(各4例)及び肝機能が正常な健康成人(8例)にデスロラタジン錠7.5mgを空腹時に単回経口投与したとき、血漿中デスロラタジン濃度の薬物動態パラメータは以下の表に示したとおりでした。肝機能障害患者のCmax及びAUCは、健康成人と比較してそれぞれ約1.8~2.2倍及び約2.0~2.9倍に上昇しました。
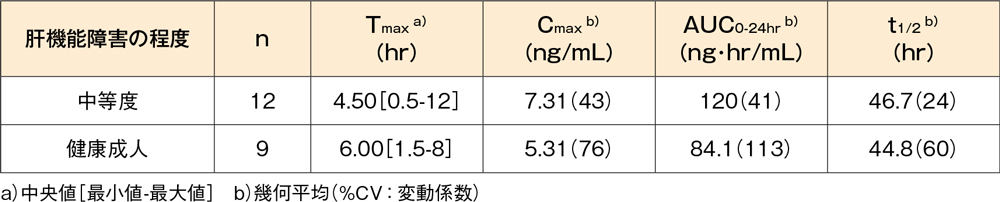
中等度(Child-Pughスコア:7~9)の慢性肝機能障害患者(12例)及び肝機能が正常な健康成人(9例)にデスロラタジン錠5mgを1日1回10日間反復経口投与したとき、血漿中デスロラタジン濃度の薬物動態パラメータは以下の表に示したとおりでした。肝機能障害患者では、健康成人と比較してCmax及びAUCがいずれも約1.4倍に上昇しました。
肝機能障害患者にデスロラタジン錠7.5mgを単回投与したときの薬物動態パラメータ
肝機能障害患者にデスロラタジン錠5mgを1日1回10日間反復投与したときの薬物動態パラメータ
6.用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。9.特定の背景を有する患者に関する注意
- 9.3
-
肝機能障害患者
デスロラタジンの血漿中濃度が上昇するおそれがある。[16.6.2 参照]
11.副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
- 11.1.4
-
肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTP、Al-P、LDH、ビリルビン等の著しい上昇を伴う肝機能障害、黄疸があらわれることがある。
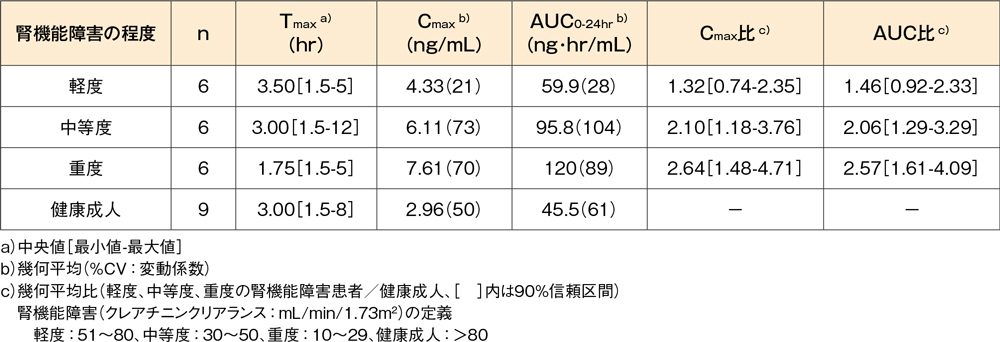
腎機能障害患者(外国人データ)7)
軽度(6例)、中等度(6例)又は重度(6例)の慢性腎機能障害患者にデスロラタジン錠5mgを1日1回14日間反復経口投与したとき、腎機能が正常な健康成人(9例)と比較してCmax及びAUCは軽度~中等度腎機能障害患者で約1.3~2.1倍、重度腎機能障害患者で約2.6倍に、それぞれ上昇しました。
腎機能障害患者にデスロラタジン錠5mgを1日1回14日間反復投与したときの
定常状態時の薬物動態パラメータ
血液透析患者(外国人データ)8)
デスロラタジンは血液透析によってほとんど除去されず、末期腎不全患者(外国人6例)にデスロラタジン錠7.5mgを単回投与後4~8時間に実施した血液透析による除去率は、投与量の約0.3%(算術平均)でした。
6.用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。9.特定の背景を有する患者に関する注意
- 9.2
-
腎機能障害患者
デスロラタジンの血漿中濃度が上昇するおそれがある。[16.6.1 参照]
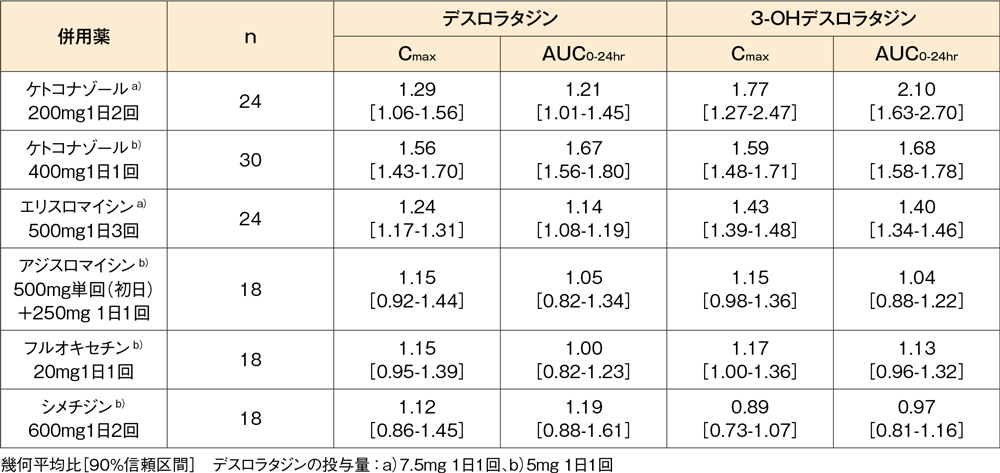
薬物相互作用(外国人データ)9-13)
健康成人を対象として、CYP3A4の阻害剤(ケトコナゾール※、エリスロマイシン、アジスロマイシン)、CYP2D6の阻害剤(フルオキセチン)又はCYP3A4及び2D6の阻害剤(シメチジン)とデスロラタジン錠5mg又は7.5mgを反復併用投与したとき、血漿中デスロラタジン及び3-OHデスロラタジン濃度の変化率は下表に示すとおりでした。
また、いずれの併用においてもQTc間隔を含めた心電図への影響は認められませんでした。
※国内では外用剤のみ発売
デスロラタジン錠5mg又は7.5mgの薬物動態に及ぼす他剤の影響
6.用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。2.分布
体内分布1)
日本人健康成人8例にデスロラタジン錠5mgを単回投与した際の見かけの分布容積は3,260(39)L(幾何平均(%CV))でした。
母乳中への移行
ヒトでの該当資料なし
[参考](外国人データ)14)
ロラタジンの40mgカプセル※を授乳婦(6例:年齢19~28歳)に単回経口投与した海外試験において、デスロラタジンの母乳中への移行が認められています。投与後48時間までに母乳中に分泌されたロラタジン及びデスロラタジンの割合は、投与量のそれぞれ0.01%及び0.02%でした。
※国内では未発売
組織への移行
ヒトでの該当資料なし
[参考](ラット)15)
ラットに14C-デスロラタジンを単回経口投与したとき、投与放射能は大部分の組織に広範に分布し、特に下垂体、甲状腺、副腎、肺及び肝臓に高濃度に分布しました。組織中放射能濃度は血漿より高く、脂肪、有色眼、腎臓及び甲状腺では、血漿又はその他の組織と比較して放射能の消失が遅延しました。
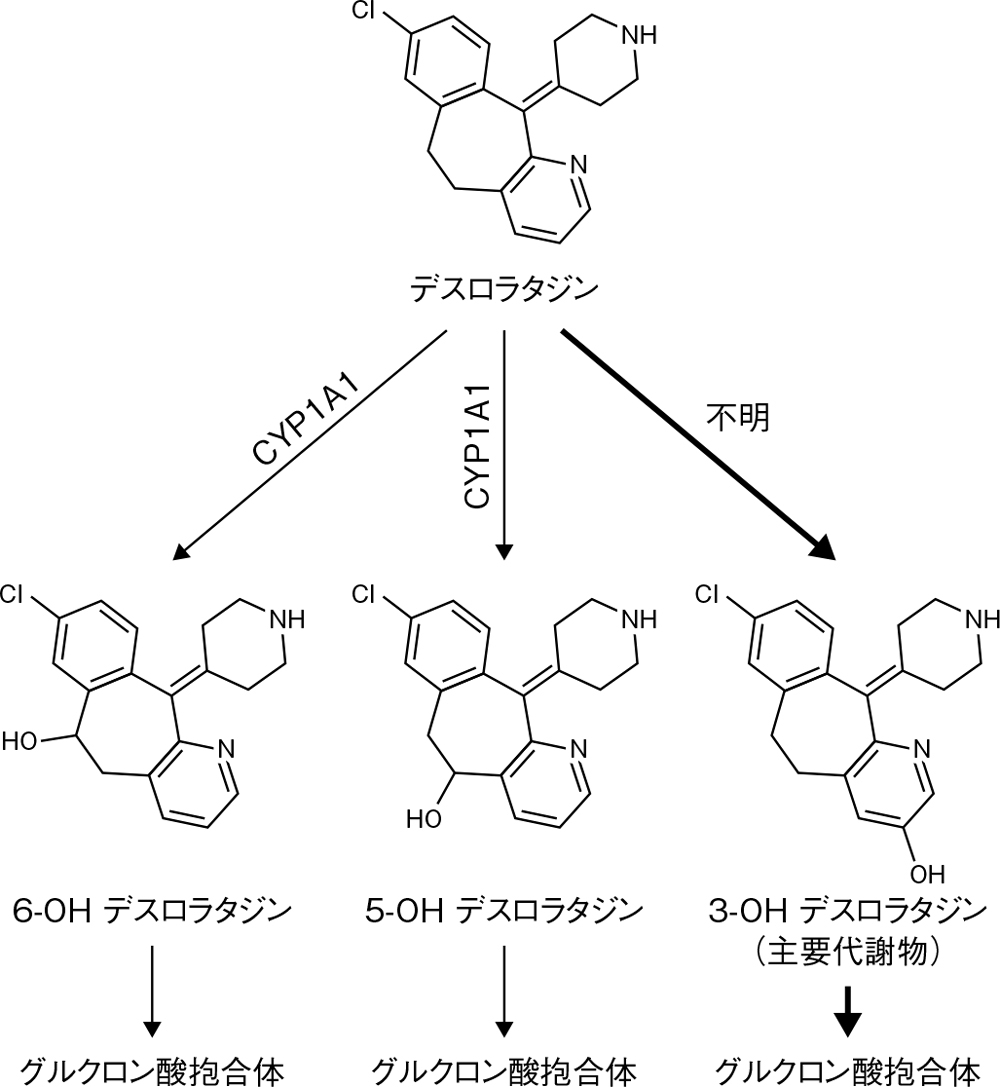
3.代謝(外国人データ)
代謝部位及び代謝経路16)
代謝部位:肝臓
健康成人男性(6例)に14C-デスロラタジン10mgを経口投与したとき、デスロラタジンは、主に3-OHデスロラタジンに代謝されたのち、グルクロン酸抱合体へと代謝されます。
6.用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。4.排泄(外国人データ)17)
健康成人男性(5例)に14C-デスロラタジン10mgを空腹時に単回経口投与したとき、240時間までに投与放射能の87.1%が代謝物として尿中(40.6%)及び糞中(46.5%)に排泄されました。未変化体の尿中及び糞中への排泄率はそれぞれ1.7%及び6.7%でした。
6.用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。5.血漿蛋白結合率(in vitro)18)
ヒト血漿に14C-デスロラタジンを添加したときの蛋白結合率は82.8~87.2%でした。
- 1)社内資料(薬物動態:単回投与、反復投与)
- 2)社内資料(薬物動態:食事の影響)
- 3)社内資料(薬物相互作用:グレープフルーツジュース)
- 4)社内資料(薬物動態:小児)
- 5)社内資料(薬物動態:高齢者)
- 6)社内資料(薬物動態:肝機能障害患者)
- 7)社内資料(薬物動態:腎機能障害患者)
- 8)社内資料(薬物動態:腎機能障害患者)
- 9)社内資料(薬物相互作用:ケトコナゾール)
- 10)社内資料(薬物相互作用:エリスロマイシン)
- 11)社内資料(薬物相互作用:アジスロマイシン)
- 12)社内資料(薬物相互作用:フルオキセチン)
- 13)社内資料(薬物相互作用:シメチジン)
- 14)Hilbert J et al. J Clin Pharmacol 1988; 28(3): 234-239
- 15)社内資料(薬物動態:組織分布)
- 16)社内資料(薬物動態試験:代謝)
- 17)社内資料(吸収、代謝及び排泄)
- 18)社内資料(薬物動態試験:血漿蛋白結合率)
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

