-製品・患者指導情報-
日本標準商品分類番号:872399
医薬品リスク管理計画対象品
ジムソ膀胱内注入液50%の製品基本情報-Product information-
2.禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
8.重要な基本的注意
投与時反応(膀胱痛、尿道痛、膀胱刺激症状、膀胱不快感等)があらわれることがあるため、必要に応じて、本剤投与前に局所麻酔剤の膀胱内注入を行った上で投与すること。
9.特定の背景を有する患者に関する注意
- 9.5
-
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験において、マウス(5g/kg以上、腹腔内)、ラット(8g/kg以上、腹腔内)、ハムスター(3.8g/kg以上、腹腔内及び静脈内)で催奇形性が認められたとの報告がある。 - 9.6
-
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤のヒト乳汁中への移行は不明であるが、本剤の分子量は小さく、かつ血漿タンパク結合率が低いため、乳汁中に移行する可能性がある。 - 9.7
-
小児等
小児等を対象とした臨床試験は実施していない。
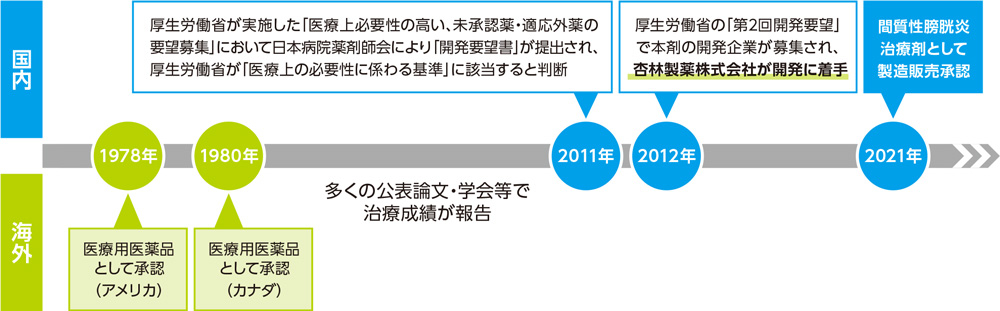
ジムソ膀胱内注入液の開発の経緯-History-
ジムソ膀胱内注入液の特性-Characteristic-
01POINT
本邦初*1の間質性膀胱炎治療剤です。
02POINT
2週間間隔で6回膀胱内に注入することで間質性膀胱炎(ハンナ型)の諸症状*2を改善しました。
03POINT
国内第Ⅲ相試験において、O'Leary & Sant間質性膀胱炎症状スコア(ICSI)のベースラインからの変化量でプラセボに対する優越性が検証されました。(12週、p=0.0188、MMRMM)
04POINT
国内第Ⅲ相試験において、O'Leary & Sant間質性膀胱炎問題スコア(ICPI)、24時間あたりの平均排尿回数、1回平均排尿量、1回最大排尿量をプラセボに比べて有意に改善しました。(12週、p=0.0014、p=0.0068、p=0.0042、p=0.0023、MMRM)
05POINT
主な副作用(発現頻度5%以上)は、膀胱痛(30.6%)、尿道痛、膀胱刺激症状、膀胱不快感、頻尿、呼気臭・皮膚臭異常(ニンニク様の臭い)などが報告されています。
電子添文の副作用及び臨床成績の安全性の結果をご参照ください。
電子添文の副作用及び臨床成績の安全性の結果をご参照ください。
- *1:製造販売承認を取得した医薬品として
- *2:膀胱に関連する慢性の骨盤部の疼痛、圧迫感及び不快感、尿意亢進又は頻尿等の下部尿路症状
製品特性3,4の臨床成績には承認外の非ハンナ型症例も含まれます


