-製品・患者指導情報-
日本標準商品分類番号:87449
医薬品リスク管理計画対象品
デザレックス錠の製品基本情報-Product information-
2. 禁忌(次の患者には投与しないこと)
- 2.1
- 本剤の成分又はロラタジンに対し過敏症の既往歴のある患者
3. 組成・性状
3.1 組成
| 販売名 | デザレックス®錠5mg |
|---|---|
| 有効成分 | 1錠中 デスロラタジン 5mg |
| 添加剤 | リン酸水素カルシウム水和物、結晶セルロース、トウモロコシデンプン、タルク、乳糖水和物、ヒプロメロース、酸化チタン、マクロゴール400、三二酸化鉄、黒酸化鉄、カルナウバロウ、サラシミツロウ |
3.2 製剤の性状
| 販売名 | デザレックス®錠5mg | |
|---|---|---|
| 剤形・色調 | 円形・フィルムコーティング錠・うすい赤色 | |
| 外形 | 表面 |
 直径:6.4mm |
| 裏面 |
 |
|
| 側面 |
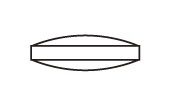 厚さ:3.0mm |
|
| 質量 | 約107mg | |
| 識別コード | C5 | |
4.効能又は効果
○ アレルギー性鼻炎
○ 蕁麻疹
○ 皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒
6.用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。
8.重要な基本的注意
〈効能共通〉
- 8.1
- 効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
〈アレルギー性鼻炎〉
- 8.2
- 季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
9.特定の背景を有する患者に関する注意
- 9.1
- 合併症・既往歴等のある患者
- 9.1.1
-
てんかんの既往のある患者
十分な問診を行うこと。発作があらわれることがある。[11.1.2 参照] - 9.2
-
腎機能障害患者
デスロラタジンの血漿中濃度が上昇するおそれがある。[16.6.1 参照] - 9.3
-
肝機能障害患者
デスロラタジンの血漿中濃度が上昇するおそれがある。[16.6.2 参照] - 9.5
-
妊婦
妊婦又は妊娠している可能性のある女性には、投与を避けることが望ましい。本剤の動物試験(ラット、ウサギ)で催奇形性は認められていないが、ロラタジンを投与したラットの試験でデスロラタジンの胎児への移行が報告されている。 - 9.6
-
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ロラタジンの臨床試験で、デスロラタジンのヒト母乳中への移行が報告されている1)。
1)Hilbert J et al. J Clin Pharmacol 1988; 28(3): 234-239
利益相反:著者は旧Schering-Ploughの社員 - 9.7
-
小児等
国内において、低出生体重児、新生児、乳児、幼児及び12歳未満の小児を対象とした臨床試験は実施していない。 - 9.8
-
高齢者
一般に生理機能が低下している。
10.相互作用
10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
エリスロマイシン |
デスロラタジン及び3-OHデスロラタジンの血漿中濃度の上昇が認められた。 | 機序不明 |
11.副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
- 11.1
- 重大な副作用
- 11.1.1
-
ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(チアノーゼ、呼吸困難、血圧低下、血管浮腫等)があらわれることがある。 - 11.1.2
-
てんかん(頻度不明)
[9.1.1 参照] - 11.1.3
- 痙攣(頻度不明)
- 11.1.4
-
肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTP、Al-P、LDH、ビリルビン等の著しい上昇を伴う肝機能障害、黄疸があらわれることがある。
11.2 その他の副作用
| 2%未満 | 頻度不明 | |
|---|---|---|
| 神経系障害 | 傾眠 | 頭痛、精神運動亢進 |
| 心臓障害 | 頻脈、動悸 | |
| 胃腸障害 | 口内乾燥 | |
| 皮膚及び皮下組織障害 | 発疹 | |
| 一般・全身障害及び投与部位の状態 | 疲労 | |
| その他 | 白血球数増加、血中コレステロール増加 | 食欲亢進 |
12.臨床検査結果に及ぼす影響
アレルゲン皮内反応を抑制するため、アレルゲン皮内反応検査を実施する3~5日前から本剤の投与を中止すること。
13.過量投与
- 13.1
-
処置
本剤は血液透析によって除去できない。
14.適用上の注意
- 14.1
-
薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
20.取扱い上の注意
外箱開封後は遮光して保存すること。
21.承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22.包装
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
デザレックス錠の特性-Characteristic-
01POINT
デザレックス®はヒスタミンH1受容体に親和性を示します。
02POINT
国内第Ⅲ相二重盲検比較試験において、季節性アレルギー性鼻炎における鼻症状を改善しました。
03POINT
国内第Ⅲ相二重盲検比較試験において慢性蕁麻疹、国内第Ⅲ相非盲検長期投与試験において皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒を改善しました。
04POINT
1日1回投与で食事の有無に関係なく服用できます。
05POINT
重大な副作用として、ショック、アナフィラキシー、てんかん、痙攣、肝機能障害、黄疸が報告されています(いずれも頻度不明)。
主な副作用として、傾眠、白血球数増加、血中コレステロール増加でした(いずれも発現頻度2%未満)。
電子添文の副作用及び臨床成績の安全性の結果をご参照ください。
主な副作用として、傾眠、白血球数増加、血中コレステロール増加でした(いずれも発現頻度2%未満)。
電子添文の副作用及び臨床成績の安全性の結果をご参照ください。



