-薬効薬理/製剤学的事項-
◆薬効薬理
1.作用機序
作用部位・作用機序
デスロラタジンは、H1受容体においてヒスタミンとの拮抗作用を示し、各種刺激によるヒスタミン遊離抑制(in vitro[花粉症又は非花粉症由来ヒト末梢血白血球])、IgE受容体の架橋によるヒスタミン遊離抑制、並びにロイコトリエンC4及びプロスタグランジンD2産生抑制(in vitro[ヒト肺組織由来肥満細胞])、炎症性サイトカイン産生抑制(in vitro[HMC-1細胞、KU812細胞、ヒト末梢血好塩基球])、血管内皮細胞の接着因子発現抑制及び炎症性サイトカイン産生抑制(in vitro[HUVEC])などの抗アレルギー性炎症作用が考えられます。
2.臨床薬理試験
膨疹及び発赤反応抑制作用(海外データ)1)
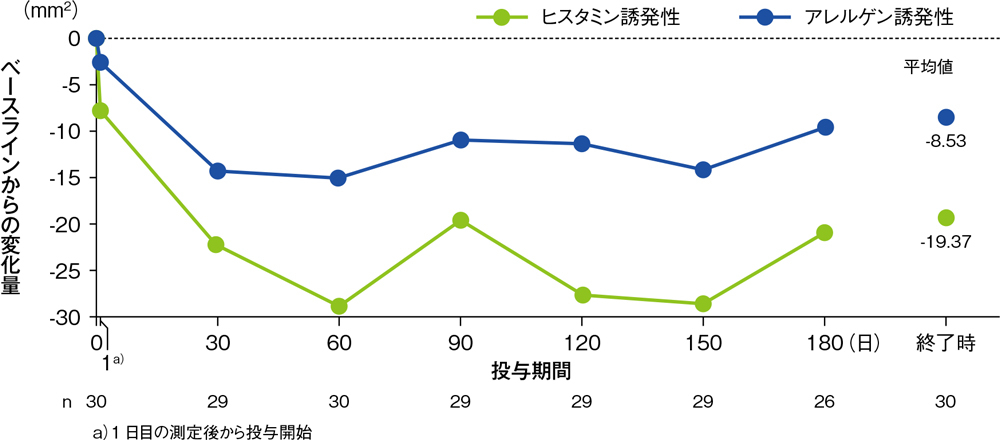
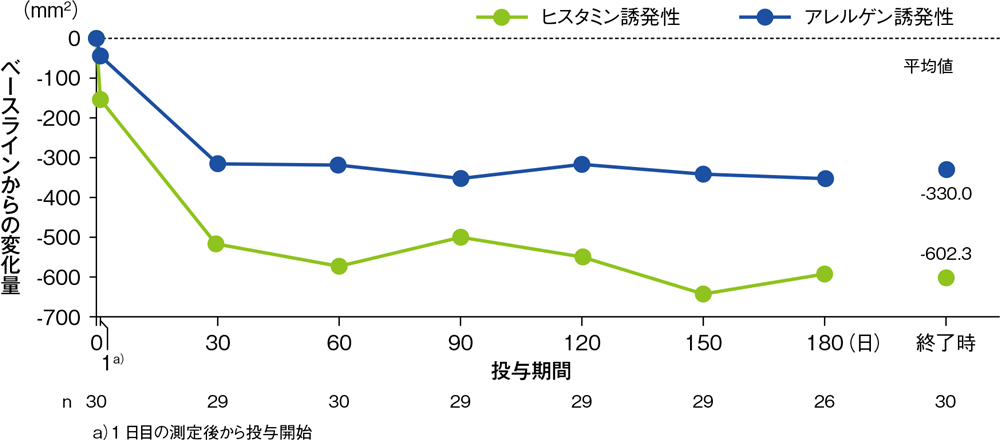
アレルギー症状を有する被験者30例に対し、デスロラタジン5mgを1日1回180日間経口投与し、皮膚プリック法にてヒスタミン又はアレルゲンを塗布して、15分後に膨疹及び発赤の面積を測定しました。デスロラタジン5mgは投与開始後30~180日目まで、ヒスタミン又はアレルゲン誘発皮内反応(膨疹及び発赤)の面積を継続的に抑制し、タキフィラキシーは認められませんでした(それぞれの95%信頼区間の上限は30日目以降のすべての測定時点で0mm2未満でした)。
ヒスタミン又はアレルゲン誘発性膨疹面積のベースラインからの変化量の推移
ヒスタミン又はアレルゲン誘発性発赤面積のベースラインからの変化量の推移
自動車運転能力への影響(海外データ)2)
健康成人男女(18例)を対象にデスロラタジン5mgを単回投与し、路上での自動車運転能力及び精神運動機能に及ぼす影響を検討した結果、自動車運転能力及び精神運動機能に影響は認められませんでした。
アルコール併用時の精神運動機能への影響(海外データ)3)
健康成人男女(23例)を対象にアルコール併用又は非併用下でデスロラタジン7.5mgを単回投与し、精神運動機能に及ぼす影響を検討した結果、アルコール併用の有無にかかわらず精神運動機能に影響は認められませんでした。
6.用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。日中の眠気への影響(海外データ)4)
健康成人男女を対象にデスロラタジン7.5mgを単回投与し、日中の眠気及び精神運動機能を評価した2試験の結果(19例及び22例)、日中の眠気(覚醒維持検査スコア及び睡眠潜時反復検査スコア)及び精神運動機能に影響は認められませんでした。
6.用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。操縦能力への影響(海外データ)5)
健康成人男性(21例)を対象にデスロラタジン5mgを単回投与し、飛行条件を模した低圧室内での眠気及び操縦操作能力に及ぼす影響を検討した結果、眠気及び操縦操作能力に影響は認められませんでした。
デスロラタジンの脳内受容体占拠率6)
健康成人男性(8例)にデスロラタジン5mgの単回投与後、脳内ヒスタミンH1受容体占拠率を[11C]-ドキセピンを用いたPETイメージングで計測しました。デスロラタジン5mgの脳内ヒスタミンH1受容体占拠率は6.47±10.5%(平均±標準偏差)であり、デスロラタジンは非鎮静性抗ヒスタミン薬に分類されました。
心電図への影響(海外データ)7)
健康成人男女(24例)にデスロラタジン錠45mg(臨床用量の9倍)を1日1回10日間反復投与したとき、QTc間隔※の最大値の変化量はプラセボと比較して統計的に有意な差は認められず、臨床的に意味のある心電図所見及びQTc間隔※の延長は認められませんでした。
※Bazettの式を用いた心拍数で補正したQT間隔
6.用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。3.非臨床試験
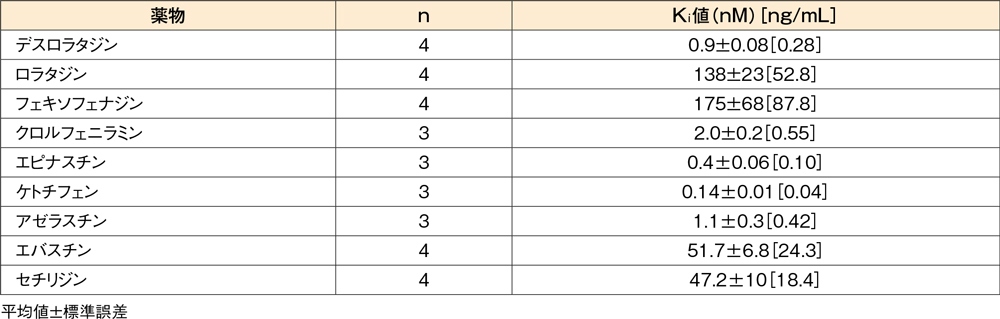
ヒトヒスタミンH1受容体拮抗作用
ヒトヒスタミンH1受容体に対する競合結合試験(in
vitro)8,9)
ヒトヒスタミンH1受容体を発現させたCHO(チャイニーズハムスター卵巣)細胞より調製した膜標品において、デスロラタジンは3H-ピリラミン(ヒスタミンH1受容体リガンド)の結合を濃度依存的に阻害し、その阻害定数(Ki値)は0.9nM(0.28ng/mL)でした。
ヒトヒスタミンH1受容体に対する3H-ピリラミン結合の阻害(競合結合試験)
ヒトヒスタミンH1受容体に対する飽和結合、結合及び解離試験(in vitro)9)
飽和結合試験を実施した結果、デスロラタジンの解離定数(KD値)は1.1±0.2nM(0.34ng/mL)でした。さらに、デスロラタジンのヒトヒスタミンH1受容体への結合量は時間依存的に増加し、約60分でほぼ飽和しました。デスロラタジンの受容体からの解離速度は遅く、6時間後の解離率は37%でした。
抗ヒスタミン作用
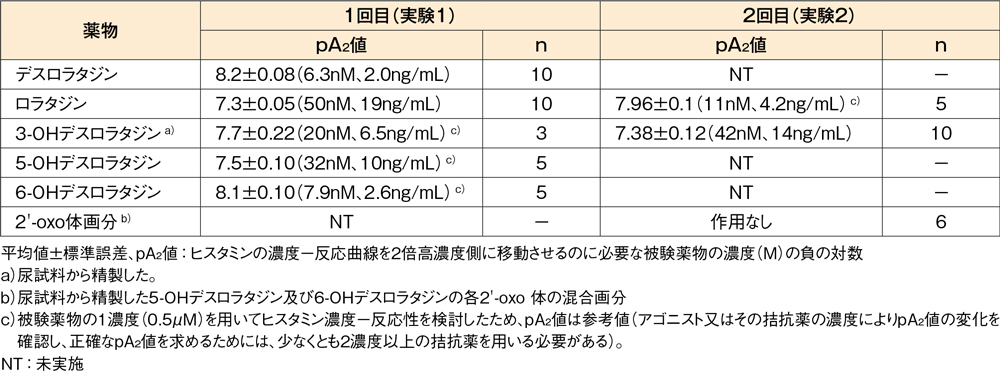
モルモット摘出回腸のヒスタミン誘発収縮に対する抑制作用(in vitro)10,11)
モルモット摘出回腸を用いたヒスタミン累積添加による濃度-反応曲線において、デスロラタジンは収縮抑制作用を示しました。デスロラタジンと比較した代謝物の作用は、6位水酸化体(6-OHデスロラタジン)でほぼ同程度、3及び5位水酸化体(3-OHデスロラタジン及び5-OHデスロラタジン)では弱いという結果でした。
モルモット摘出回腸のヒスタミン誘発収縮に対する作用
抗ヒスタミン作用の阻害様式(in vitro)8)
ヒトヒスタミンH1受容体を発現させたCHO細胞において、デスロラタジンは細胞内Ca2+濃度([Ca2+]i)上昇の濃度-反応曲線を濃度依存的に高濃度側にシフトさせ、ヒスタミンの最大反応を低下させました。
ヒスタミン誘発足蹠浮腫に対する作用(マウス)12)
デスロラタジン(0.03~1.0mg/kg)をマウスに経口投与1時間後、後肢足蹠皮下へ生理食塩液に溶解したヒスタミン二塩酸塩を投与し、30分後に切断して重量差を求めました。その結果、デスロラタジンはヒスタミン誘発足蹠浮腫を抑制し、そのときのデスロラタジンの50%作用用量(ED50値)は0.15mg/kgでした。
ヒスタミン誘発致死に対する作用(モルモット)12)
モルモットにデスロラタジンを経口投与1時間後、致死量のヒスタミン二塩酸塩を静脈内投与して30分後の致死防御率を求めました。その結果、デスロラタジンはヒスタミン誘発致死防御作用を示し、そのときのデスロラタジンのED50値は0.15mg/kg(経口)でした。
ヒスタミン誘発鼻腔内色素漏出に対する作用(モルモット)12)
モルモットにデスロラタジンを点鼻投与10分後、ヒスタミン溶液を鼻腔内に灌流してヒスタミン誘発鼻腔内色素漏出に対する抑制作用を検討しました。その結果、デスロラタジンの局所抗ヒスタミン作用のED50値は0.9μg/両鼻腔でした。
ヒスタミン誘発気道収縮に対する作用(カニクイザル)12)
麻酔カニクイザルにデスロラタジンを胃内投与2時間後、ヒスタミンを累積的に静脈内投与してヒスタミン誘発気道収縮に対する作用を検討した結果、デスロラタジン6.5mg/kgによりヒスタミン誘発気道収縮(肺抵抗増加及び肺コンプライアンス減少)はほぼ完全に抑制されました。
作用の持続性(モルモット)10)
モルモットに抗ヒスタミン作用を示す用量(ED50値)の約3倍量のデスロラタジンを単回経口投与し、1~24時間後にヒスタミン二塩酸塩1.1mg/kgを静脈内投与し、致死防御率を求めた結果、経口投与後24時間にわたって、モルモットのヒスタミン誘発致死防御作用を示しました。
アレルギー性炎症に及ぼす影響
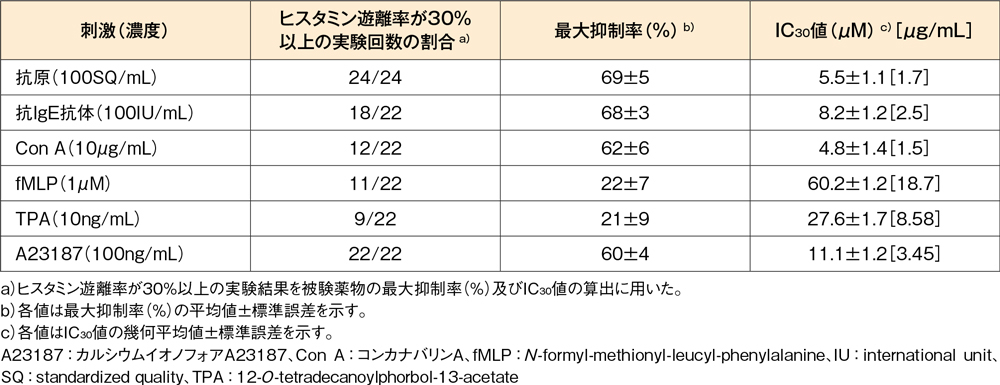
【参考情報】各種刺激によるヒスタミン遊離に及ぼす影響(in vitro)13)
花粉症(24例)のヒト末梢血白血球を抗原(オオアワガエリ花粉抗原抽出液)で刺激、あるいは非花粉症(22例)のヒト末梢血白血球を抗IgE抗体、Con A、fMLP、TPA又はA23187で刺激したときのヒスタミン遊離に対して、デスロラタジンは各種刺激に対するヒスタミン遊離を抑制し、そのIC30値は4.8~60.2μM(1.7~18.7μg/mL)でした。
ヒト末梢血白血球からの各種刺激によるヒスタミン遊離に対するデスロラタジンの作用
【参考情報】IgE受容体の架橋によるヒスタミン遊離、LTC4及びPGD2産生に及ぼす影響(in vitro)14)
ヒト肺組織由来マスト細胞を抗IgE受容体抗体で刺激したときの、ヒスタミン遊離(蛍光法)、ロイコトリエンC4(LTC4)及びプロスタグランジンD2(PGD2)産生(放射免疫測定法)に対するデスロラタジンの作用を検討した結果、約10μM(3.1μg/mL)以上で抑制傾向を示しました。
【参考情報】炎症性サイトカインの産生に及ぼす影響(in vitro)15)
- ①
-
インターロイキン(IL)-6、IL-8産生に対するデスロラタジンの影響
炎症細胞をTPA及びA23187で共刺激したときのIL-6及びIL-8の産生に対して、デスロラタジンは、10nM(3.1ng/mL)で、HMC-1細胞(ヒトマスト細胞由来細胞株)及びKU812細胞(ヒト好塩基球由来細胞株)からのIL-6産生をぞれぞれ44%及び38%抑制し、IL-8産生をそれぞれ48%及び42%抑制しました。
TPA:12-O-tetradecanoylphorbol-13-acetate、 A23187:カルシウムイオノフォアA23187
- ②
-
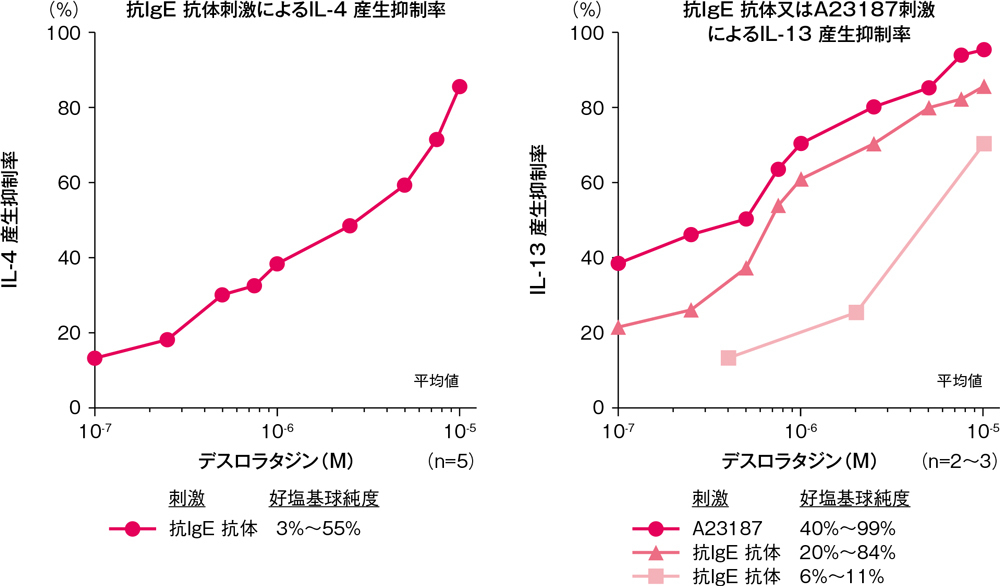
IL-4、IL-13産生に対するデスロラタジンの影響
ヒト末梢血好塩基球からのIL-4及びIL-13の産生に対して、デスロラタジンは、100nM(31ng/mL)以上で、抗IgE抗体刺激による純度3%~55%好塩基球からのIL-4産生抑制傾向、純度20%~84%好塩基球からのIL-13産生抑制傾向が示されましたが、純度6%~11%好塩基球からのIL-13産生抑制率は低値でした。また、A23187刺激による純度40%~99%好塩基球からのIL-13産生の抑制傾向が示されました。
ヒト末梢血好塩基球からのIL-4及びIL-13の産生に対する影響
【参考情報】血管内皮細胞の接着因子の発現及び炎症性サイトカインの産生に及ぼす影響(in vitro)16)
- ①
-
接着因子の発現に対するデスロラタジンの影響
ヒト臍帯静脈内皮細胞(HUVEC)をヒスタミン(10-4M)で刺激したときのP-セレクチン発現に対して、デスロラタジン及びロラタジンは抑制作用を示し、IC50値がそれぞれ23及び13nM(7.1及び5.0ng/mL)でした。
- ②
-
炎症性サイトカインの産生に対するデスロラタジンの影響
HUVECをヒスタミン(10-4M)で刺激したときのIL-6及びIL-8の産生に対して、デスロラタジンはいずれも抑制作用を示し、IC50値はIL-6産生に対して2.6pM(0.81pg/mL)、IL-8産生に対して1nM(0.31ng/mL)でした。
◆製剤学的事項
製剤の各種条件下における安定性
デザレックス®錠5mg
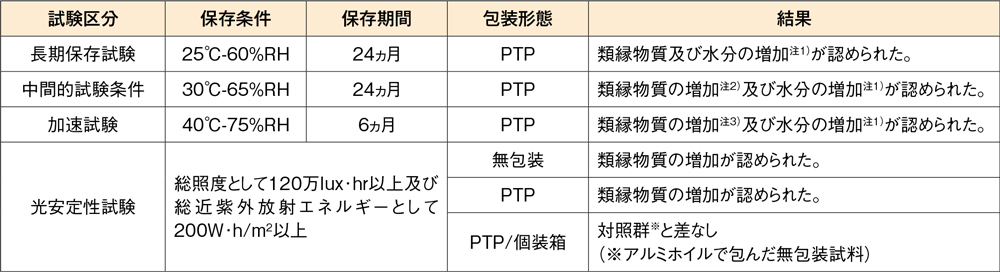
試験項目:性状、定量、類縁物質、溶出性、水分、等
注1):保存期間中、変動は規格の範囲内
注2):12ヵ月まで規格の範囲内
注3):1ヵ月まで規格の範囲内
◆取扱い上の注意
| 規制区分 |
製剤:デザレックス®錠5mg 処方箋医薬品注) 注)注意-医師等の処方箋により使用すること |
|---|---|
| 貯法 |
遮光、室温保存 |
| 使用期間 |
2年 |
| 使用期限 |
外箱に表示 |
- 1)社内資料(臨床薬理試験:投与180日目の膨疹及び発赤反応抑制作用)
- 2)社内資料(自動車運転能力及び精神運動機能への影響)
- 3)社内資料(アルコール併用下で精神運動機能への影響)
- 4)社内資料(日中の眠気への影響)
- 5)社内資料(操縦能力への影響)
- 6)Nakamura T et al. Pharmacol Res Perspect. 2019; 7(4): e00499.
利益相反:杏林製薬から資金提供を受けた - 7)社内資料(心電図への影響)
- 8)Anthes JC et al. Eur J Pharmacol 2002; 449(3): 229-237
利益相反:著者は著者は旧Schering-Ploughの社員 - 9)社内資料(薬効薬理:ヒスタミンH1受容体拮抗作用)
- 10)Kreutner W et al. Arzneimittelforschung 2000; 50(4):
345-352
利益相反:著者は著者は旧Schering-Ploughの社員 - 11)社内資料(薬効薬理:モルモット摘出回腸のヒスタミン誘発収縮に対する作用)
- 12)社内資料(薬効薬理:ヒスタミン誘発アレルギー反応に対する作用)
- 13)Kleine-Tebbe J et al. J Allergy Clin Immunol 1994; 93(2): 494-500
- 14)社内資料(薬効薬理:ケミカルメディエーター遊離に対する作用)
- 15)社内資料(薬効薬理:炎症性サイトカインの産生に対する作用)
- 16)社内資料(薬効薬理:血管内皮細胞の接着因子の発現及び炎症性サイトカインの産生に対する作用)
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

