-臨床成績 アレルギー性鼻炎-
◆季節性アレルギー性鼻炎
国内第Ⅲ相二重盲検プラセボ対照試験(季節性アレルギー性鼻炎)1)
| 目的 |
季節性アレルギー性鼻炎患者を対象としたプラセボに対するデザレックス®の有効性及び安全性の検討 |
|---|---|
| 対象 |
16歳以上の季節性アレルギー性鼻炎患者 448例
<選択基準> |
| 試験デザイン |
多施設共同、無作為化、プラセボ対照、第Ⅲ相二重盲検試験 |
| 試験方法 |
1週間の観察期間後、デザレックス®5mg群又はプラセボ群の各群に1:1の比で無作為に割り付け、二重盲検下で2週間1日1回朝経口投与した。 |
| 評価項目 |
<有効性>
副次評価項目:
<安全性> |
| 解析計画 |
主要評価項目は、デザレックス®5mg群のプラセボ群に対する優越性を検証した。主要評価項目及び副次評価項目において、制約付き経時測定データ解析モデル(時点、時点と投与群、時点と重症度の交互作用を因子とした。なお、時点はカテゴリ変数として扱った)を用いて評価した。 |
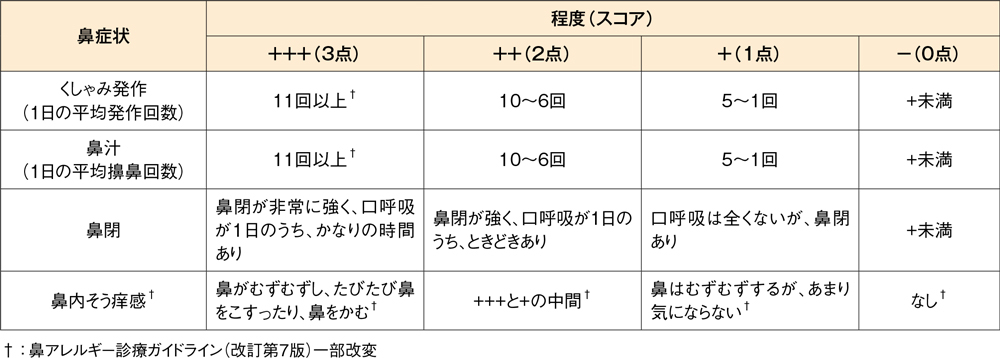
鼻症状スコア(季節性アレルギー性鼻炎)の判定基準
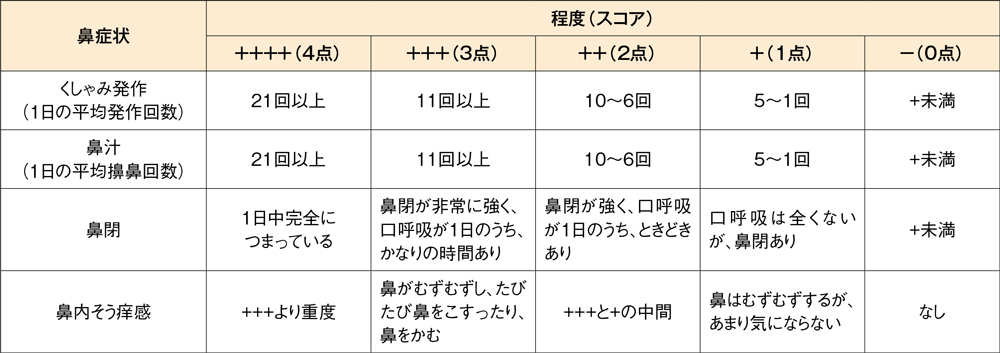
投与2週間における4鼻症状スコア合計のベースラインからの変化量[主要評価項目]
4鼻症状スコア合計のベースラインからの変化量は、デザレックス®5mg群が-1.41、プラセボ群が-0.59、投与群間の差(95%信頼区間)は-0.83(-1.14,-0.51)であり、デザレックス®5mg群のプラセボ群に対する優越性が検証されました(P<0.001、制約付き経時測定データ解析モデル)。
患者日記による4鼻症状スコア合計のベースラインからの変化量(FASa))
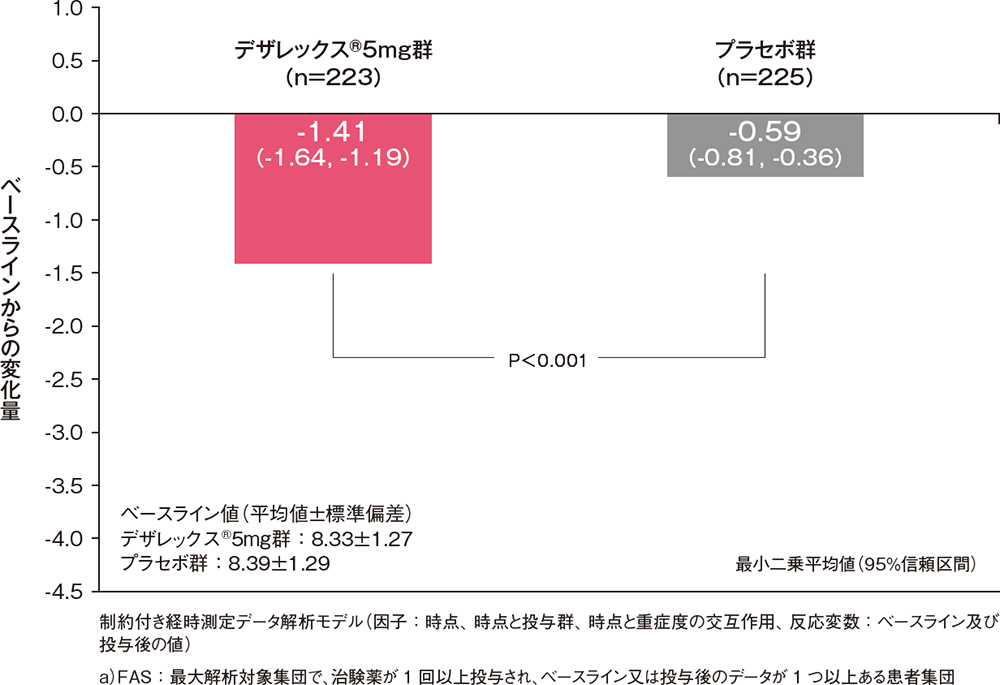
投与1週時及び2週時の4鼻症状スコア合計のベースラインからの変化量[副次評価項目]
投与1週時及び2週時(評価時点前1週間の平均)の4鼻症状スコア合計のベースラインからの変化量は、デザレックス®5mg群がプラセボ群と比較して有意な低下を示しました(P<0.001、制約付き経時測定データ解析モデル)。
患者日記による4鼻症状スコア合計のベースラインからの変化量(FAS)
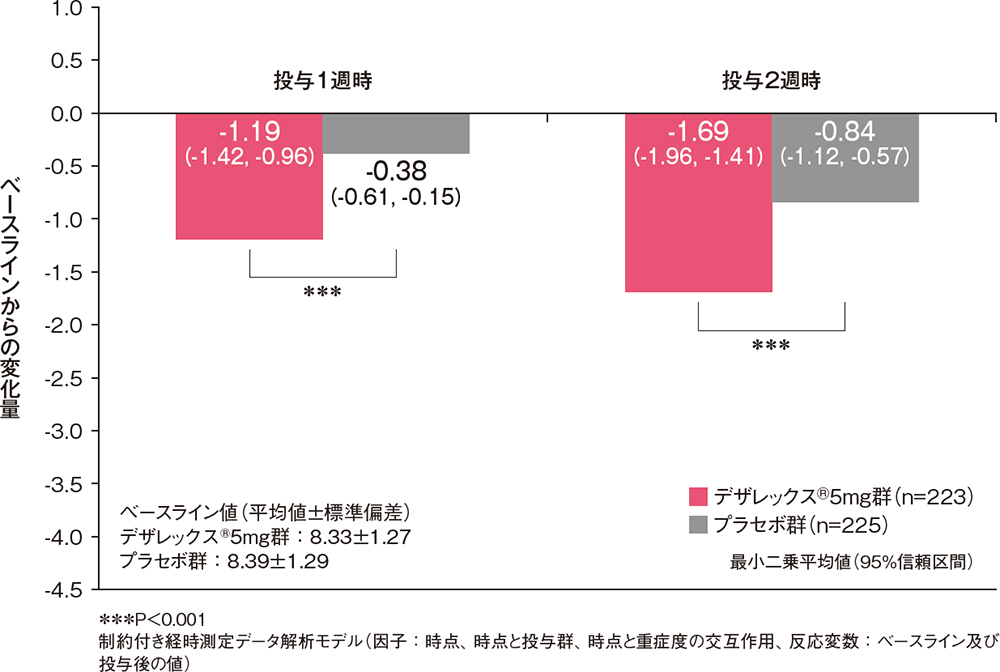
投与1週時、2週時及び2週間の各鼻症状スコアのベースラインからの変化量[副次評価項目]
各鼻症状スコア(くしゃみ発作、鼻汁、鼻閉、鼻内そう痒感)のベースラインからの変化量は、いずれの評価時点においてもデザレックス®5mg群がプラセボ群と比較して有意な低下を示しました(*P=0.008、†P=0.037、††P=0.009、***P<0.001、制約付き経時測定データ解析モデル)。
患者日記による各鼻症状スコアのベースラインからの変化量(FAS)
安全性
有害事象の発現率は、デザレックス®5mg群で8.5%(19/223例)及びプラセボ群で5.8%(13/225例)に認められました。デザレックス®5mg群で2%以上に発現した有害事象は、鼻咽頭炎[デザレックス®5mg群:2.2%(5/223例)、プラセボ群:0.4%(1/225例)]でした。重篤な有害事象は、デザレックス®5mg群の1例に術後創感染が認められましたが、治験薬との因果関係は否定されました。本試験で死亡は認められませんでした。治験薬の投与中止に至った有害事象の発現率はデザレックス®5mg群で0.9%(2/223例)及びプラセボ群で0.9%(2/225例)でした。その内訳は、デザレックス®5mg群で、術後創感染1例及び鼻咽頭炎1例、プラセボ群で頭痛及び口内乾燥1例及び鼻咽頭炎1例でした。
副作用の発現率は、デザレックス®5mg群5.8%(13/223例)及びプラセボ群4.0%(9/225例)でした。デザレックス®5mg群で2例以上に発現した副作用は、尿中蛋白陽性[デザレックス®5mg群1.3%(3/223例)、プラセボ群1.8%(4/225例)]、白血球数増加[デザレックス®5mg群1.3%(3/223例)、プラセボ群0.9%(2/225例)]、傾眠[デザレックス®5mg群0.9%(2/223例)、プラセボ群0.9%(2/225例)]でした。
海外非盲検比較試験(季節性アレルギー性鼻炎)(海外データ)2)
| 目的 |
デザレックス®の服用時間帯(朝又は夜)が季節性アレルギー性鼻炎の症状改善へ与える影響の検討 |
|---|---|
| 対象 |
18歳以上の季節性アレルギー性鼻炎患者 663例 |
| 試験デザイン |
多施設共同無作為化非盲検並行群間比較試験 |
| 試験方法 |
季節性アレルギー性鼻炎患者を2群に無作為化し、デザレックス®5mgを1日1回、朝(7~9時:336例)又は夜(19~21時:327例)に2週間経口投与し、鼻汁、鼻閉、くしゃみ及び眼症状をスコア化(各0~3)して午前及び午後に評価した。 |
| 評価項目 |
|
| 解析計画 |
主要評価項目において、朝投与と夜投与の症状スコア合計のベースラインからの変化量をtwo-way ANOVAを用いて評価した。 |
有効性
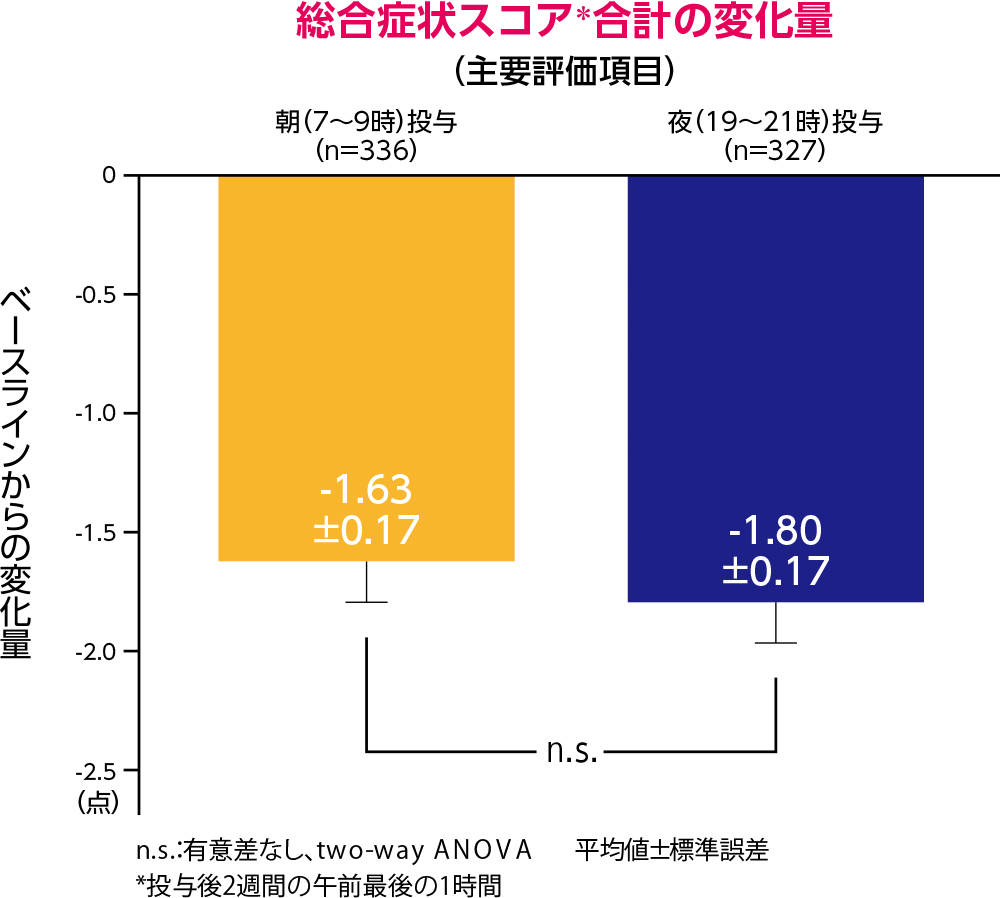
デザレックス®与後2週間の午前最後の1時間における総合症状スコアの合計の変化量は、朝投与群で-1.63(標準誤差±0.17)、夜投与群で-1.80(標準誤差±0.17)でした。朝投与群と夜投与群との間に有意差は認められませんでした。
投与後2週間の午前最後の1時間における症状スコア合計
安全性
副作用発現症例率は、朝投与群で20%、夜投与群で18%でした。主な副作用は頭痛で、それぞれ7%及び4%でした。
8.重要な基本的注意
〈効能共通〉
- 8.1
- 効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
〈アレルギー性鼻炎〉
- 8.2
- 季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
◆通年性アレルギー性鼻炎
国内第Ⅲ相二重盲検比較試験(通年性アレルギー性鼻炎)3)
| 目的 |
通年性アレルギー性鼻炎患者を対象としたプラセボに対するデザレックス®の有効性及び安全性の検討 |
|---|---|
| 対象 |
12歳以上の通年性アレルギー性鼻炎患者 608例
<選択基準> |
| 試験デザイン |
多施設共同、無作為化、プラセボ対照、第Ⅲ相二重盲検試験 |
| 試験方法 |
1週間の観察期間後、デザレックス®10mg群、デザレックス®5mg群又はプラセボ群の各群に1:1:1の比で無作為に割り付け、二重盲検下で2週間1日1回朝経口投与した※。 |
| 評価項目 |
<有効性>
副次評価項目:
<安全性> |
| 解析計画 |
主要評価項目は、デザレックス®10mg群及び5mg群のプラセボ群に対する優越性を検証した。 ※以下、主要評価項目及び副次評価項目についてはデザレックス®5mg群、プラセボ群の結果のみ記載、承認用量外の10mgはグラフから削除する。本剤の承認された用法・用量は、1日1回5mgである。 |
鼻症状スコア(通年性アレルギー性鼻炎)の判定基準
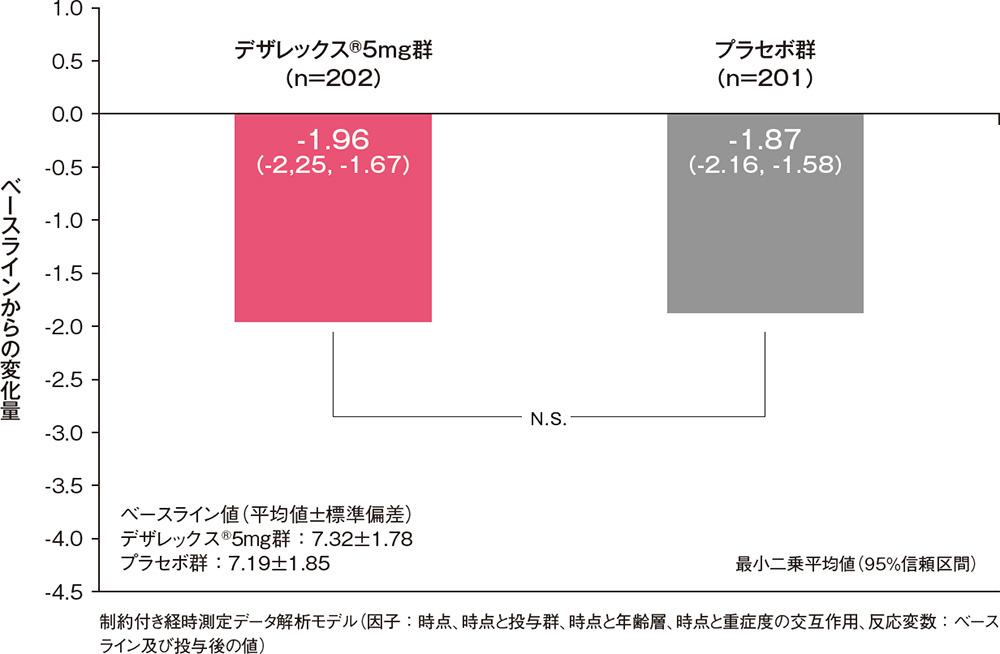
投与2週後の4鼻症状スコア合計のベースラインからの変化量[主要評価項目]
治験責任(分担)医師の評価した4鼻症状スコア合計(くしゃみ発作、鼻汁、鼻閉及び鼻内そう痒感の各スコアの合計)のベースラインからの変化量は、デザレックス®5mg群及びプラセボ群でそれぞれ-1.96及び-1.87でした。また、投与2週後の4鼻症状スコア合計のベースラインからの変化量の差(95%信頼区間)は-0.09(-0.49, 0.31)であり、プラセボ群との間に有意差は認められませんでした(制約付き経時測定データ解析モデル)。
投与2週後の4鼻症状スコア合計のベースラインからの変化量(FAS)
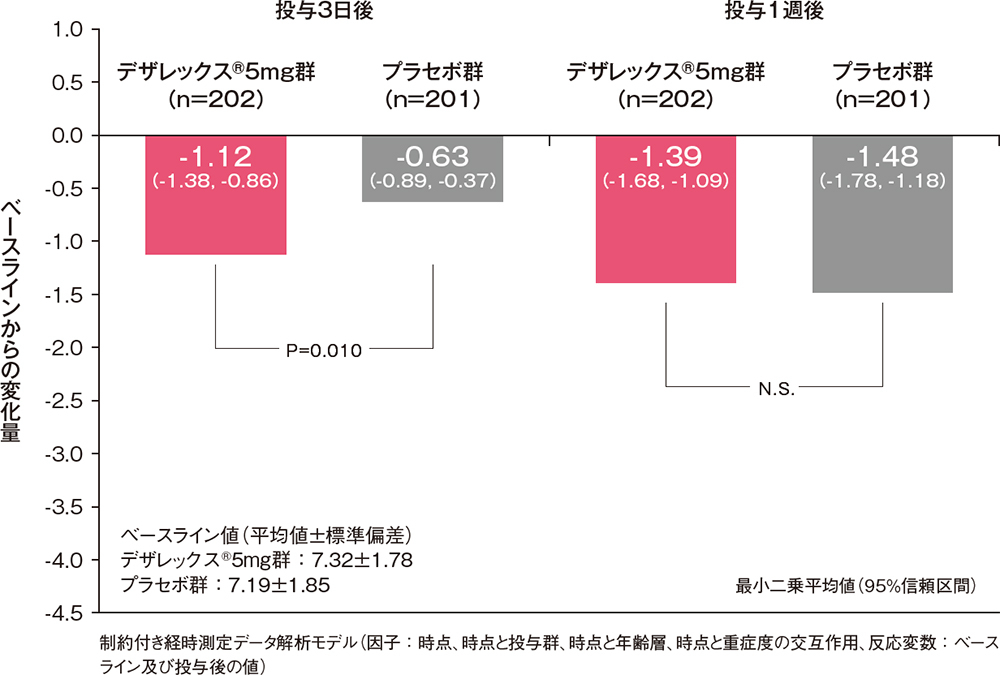
投与3日後及び1週後の4鼻症状スコア合計のベースラインからの変化量[副次評価項目]
治験責任(分担)医師の評価した4鼻症状スコアの合計(くしゃみ発作、鼻汁、鼻閉及び鼻内そう痒感の各スコアの合計)のベースラインからの変化量は、投与3日後ではデザレックス®5mg群及びプラセボ群でそれぞれ-1.12及び-0.63であり、デザレックス®5mg群はプラセボ群と比較し有意(P=0.010、制約付き経時測定データ解析モデル)な改善が認められました。また投与1週後ではデザレックス®5mg群及びプラセボ群でそれぞれ-1.39及び-1.48であり有意差は認められませんでした(制約付き経時測定データ解析モデル)。
投与3日後及び1週後の4鼻症状スコア合計のベースラインからの変化量(FAS)
安全性
有害事象の発現率は、デザレックス®5mg群で13.4%(27/202例)、10mg群で14.3%(29/203例)及びプラセボ群で10.0%(20/201例)でした。デザレックス®5mg群又は10mg群で2%以上に発現した有害事象は鼻咽頭炎[デザレックス®5mg群:5.4%(11/202例)、10mg群:8.4%(17/203例)、プラセボ群:4.5%(9/201例)]、咽頭炎[デザレックス®5mg群:1.0%(2/202例)、10mg群:2.0%(4/203例)、プラセボ群:1.5%(3/201例)]でした。重篤な有害事象はデザレックス®5mg群の1例で報告された重度のてんかんであり、治験薬との因果関係は否定されました。本試験で死亡は認められませんでした。その他の投与中止に至った有害事象は、プラセボ群の鼻咽頭炎1例、蕁麻疹1例でした。
副作用の発現率は、デザレックス®5mg群で0.0%(0/202例)、10mg群で3.0%(6/203例)及びプラセボ群で1.0%(2/201例)でした。デザレックス®5mg群又は10mg群で2例以上に発現した副作用は傾眠(デザレックス®5mg群:0/202例、10mg群:3/203例、プラセボ群:0/201例)でした。
6.用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。海外二重盲検プラセボ対照試験(持続性アレルギー性鼻炎)(海外データ)4)
| 目的 |
持続性アレルギー性鼻炎患者に対するデザレックス®の有効性及び安全性の検討 |
|---|---|
| 対象 |
18歳~65歳で2年以上の罹病歴のある中等症から重症の持続性アレルギー性鼻炎患者 |
| 試験デザイン |
多施設共同無作為化二重盲検プラセボ対照比較試験 |
| 試験方法 |
デザレックス®5mg群(293例)又はプラセボ群(291例)に無作為に割付、28日間経口投与した。 |
| 評価項目 |
主要評価項目:午前/午後の鼻閉スコアのベースラインからの変化量 副次評価項目:総合鼻症状スコア、各症状スコア及びRQLQスコアのベースラインからの変化量 等 |
| 解析計画 |
症状スコアの群間差の評価には、測定値を試験治療前の値で調整したANOVAを用いた。 |
主要評価項目・副次評価項目
デザレックス®は、持続性アレルギー性鼻炎患者において主要評価項目である鼻閉スコアを投与1週~4週のそれぞれの評価時点で有意に改善しました。
鼻症状スコアのベースラインからの変化量
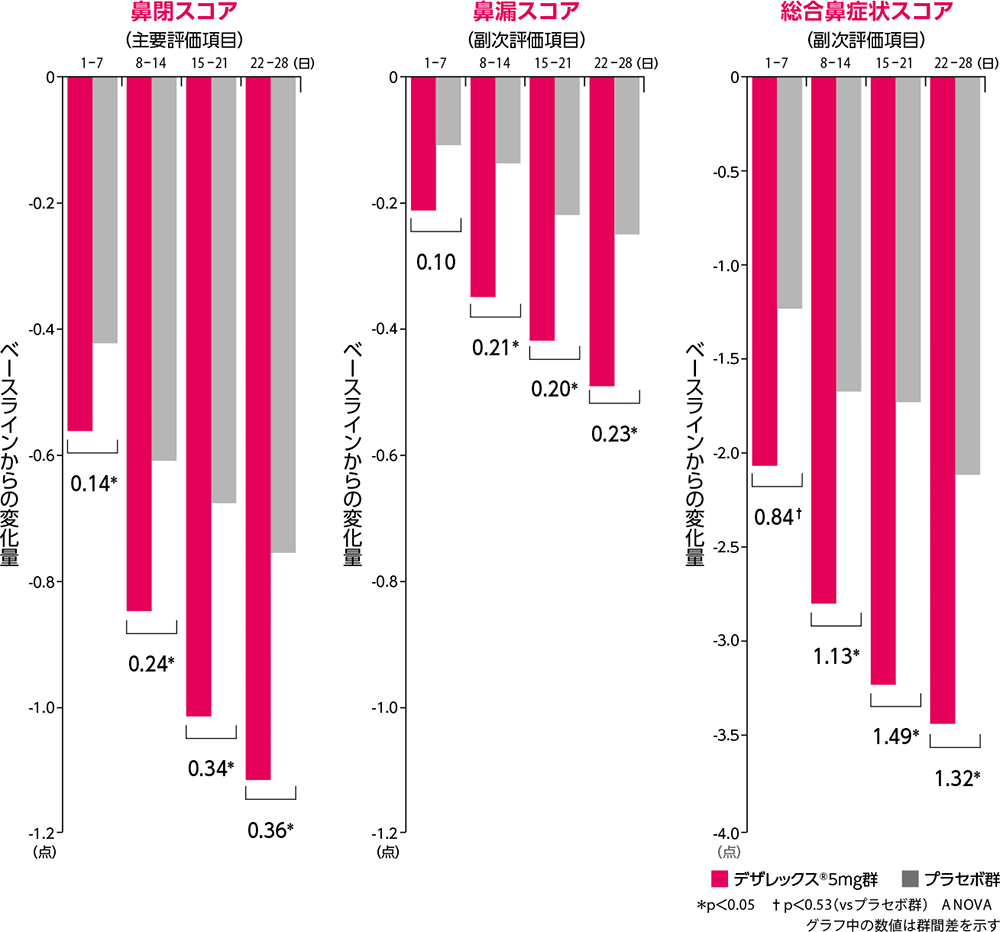
安全性
副作用はデザレックス®5mg群で9%(26/293例)、プラセボ群で8%(24/291例)に認められました。
2%以上の副作用は頭痛(デザレックス®5mg群で3%、プラセボ群で4%)でした。
- 1)承認時評価資料(季節性アレルギー性鼻炎患者対象第Ⅲ相臨床試験)
-
2)Haye R et al. Clin Mol Allergy 2005; 3(1):
3.より作図
利益相反:本研究は旧Schring-Ploughの支援により行われた。 - 3)承認時評価資料(通年性アレルギー性鼻炎患者対象第Ⅲ相臨床試験)
-
4)Holmberg K et al. Allergy 2009: 64:
1663‒1670.一部改変
利益相反:本論文の著者のうち4名は旧Schring-Ploughの社員である。
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。


