-臨床成績 疾患領域別評価-
市中肺炎患者を対象とした第Ⅱ相試験(用量設定試験)1)
| 目的 |
市中肺炎患者に対するラスビック®錠75mg及び150mgの有効性及び安全性を評価し、至適用量を検討する。 |
|---|---|
| 対象 |
20歳以上75歳未満で軽症から中等症の日本人市中肺炎患者 |
| 試験デザイン |
ステップA:非盲検非対照試験 |
| 方法 |
ステップA:
ステップB: |
| 評価項目 |
ステップA:
ステップB: |
| 解析計画 |
ステップBでは治癒率、有効率、菌消失率を算出し、その両側95%信頼区間を算出した。 |
各評価項目の算出方法
- 有効率(%)=【有効の例数】/【「有効+無効」の例数】×100
- 治癒率(%)=【治癒の例数】/【「治癒+治癒せず」の例数】×100
- 菌消失率(%)=【「消失+推定消失+菌交代症」の例数】/【「消失+推定消失+菌交代症+存続+推定存続」の例数】×100
微生物学的効果の判定基準2)
| 消失 | 適切に採取された検体から、当該抗菌薬の投与後に原因菌が検出されなかった場合。 |
|---|---|
| 推定消失 | 治療によって臨床症状が改善または消失し、当初の感染病巣から検査に適した検体が得られなくなった場合、原因菌は消失したものと推定する。 |
| 菌交代症 | 治療により当初の原因菌は消失し、それ以外の当該抗菌薬に感受性を示さない新たな病原微生物が、明らかな感染症の症状や徴候を伴って同じ部位から検出された場合。 |
| 存続 | 感染病巣から当初の原因菌が検出された場合。 |
| 推定存続 | 臨床症状の改善がみられず、適切に採取された検体からの分離培養が不可能あるいは実施されなかった場合、原因菌は存続していると推定する。 |
| 判定不能 | 種々の理由により微生物学的検査が実施されなかったなど、上述のいずれの判定もできない場合。 |
1)ステップA:安全性[主要評価項目]
ステップAで認められた有害事象は20例中7例(35.0%)10件であった。その内訳は便秘、気管支炎、感染性腸炎、C-反応性蛋白増加、白血球数増加、尿中アルブミン/クレアチニン比増加、喘息、喀血、口腔咽頭痛及びそう痒症が各1例1件であった。
また、副作用は20例中1例(5%)1件(そう痒症)であった。
ステップAにおいて有効性及び安全性は良好であったため、ステップBに進んだ。
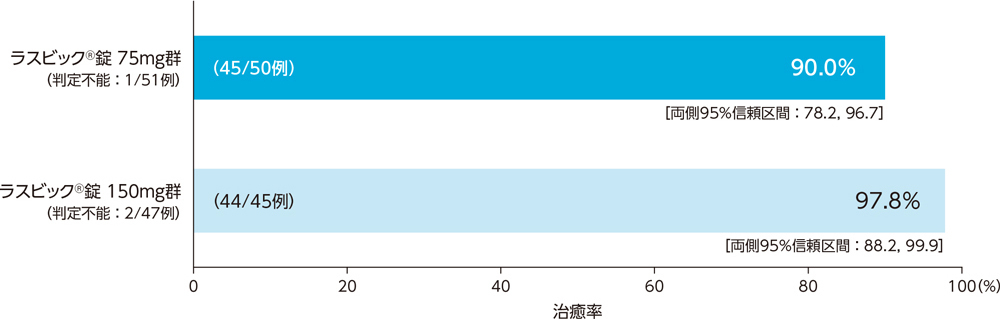
2)ステップB:投与終了7日後の臨床効果:治癒率(PPS)[主要評価項目]
市中肺炎患者に対する投与終了7日後の臨床効果(治癒率)は、ラスビック®錠75mg群で90.0%、ラスビック®錠150mg群で97.8%であった。
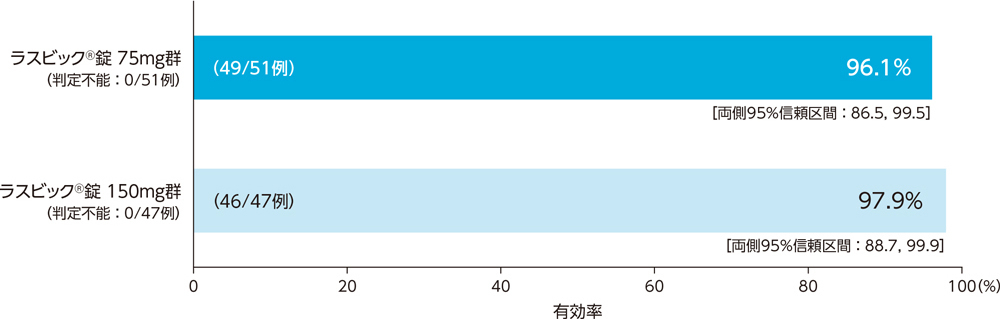
3)ステップB:投与終了時の臨床効果:有効率(PPS)[副次評価項目]
市中肺炎患者に対する投与終了時の臨床効果(有効率)は、ラスビック®錠75mg群で96.1%、ラスビック®錠150mg群で97.9%であった。
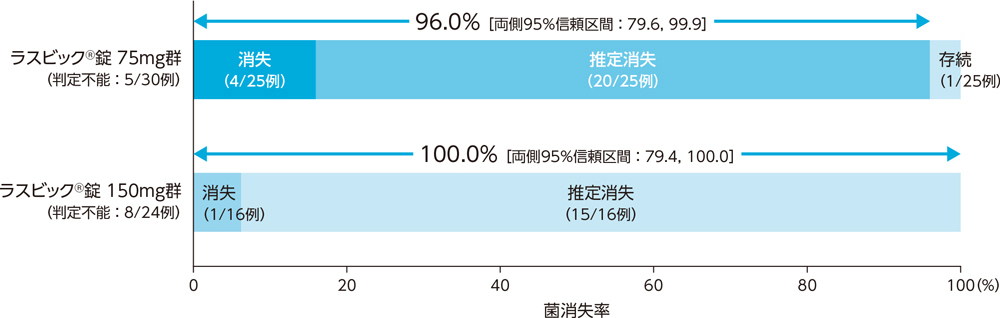
4)ステップB:投与終了7日後の微生物学的効果:菌消失率(BPPS)[副次評価項目]
市中肺炎患者に対する投与終了7日後の微生物学的効果(菌消失率)は、ラスビック®錠75mg群で96.0%、ラスビック®錠150mg群で100.0%であった。
5)ステップB:安全性
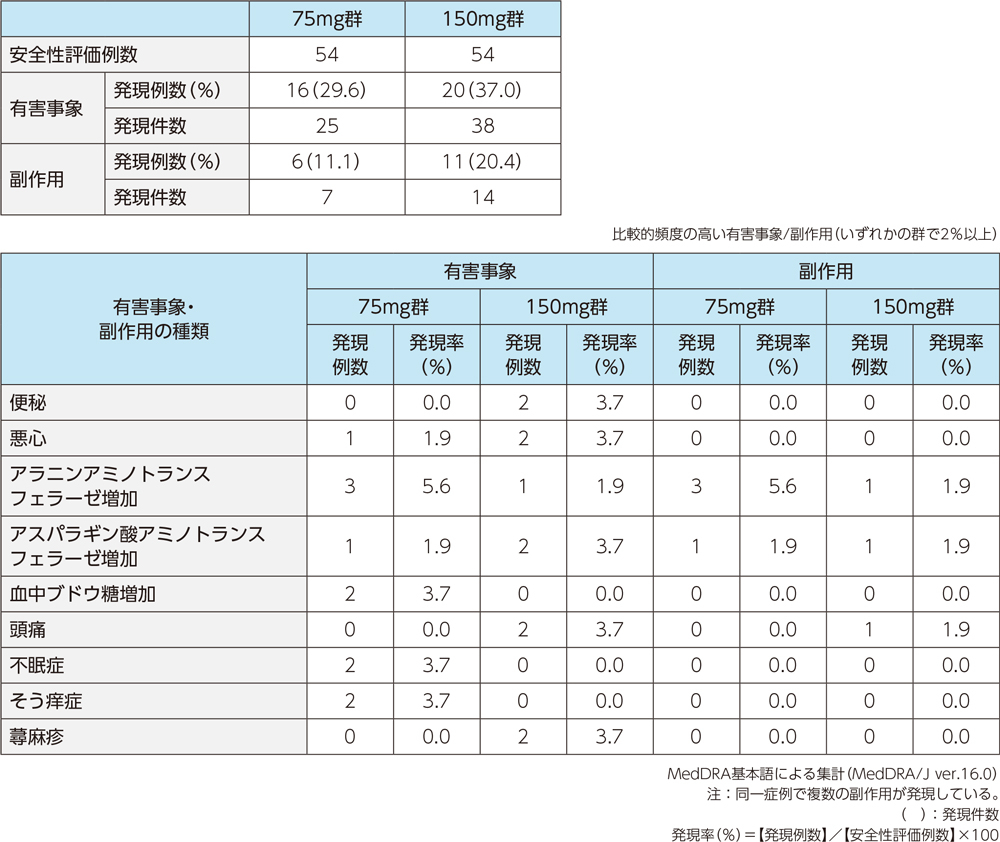
投与中止に至った有害事象は、75mg群で1例2件(アスパラギン酸アミノトランスフェラーゼ増加、アラニンアミノトランスフェラーゼ増加)、150mg群で1例1件(慢性閉塞性肺疾患)であった。重篤な有害事象は、 150mg群で2例2件(好酸球性肺炎、白血球減少症各1例1件)であった。
投与中止に至った副作用は、75mg群で1例2件(アスパラギン酸アミノトランスフェラーゼ増加及びアラニンアミノトランスフェラーゼ増加)であった。重篤な副作用は、150mg群の1例1件(白血球減少症)であった。
安全性については、75mg投与群で11.1%(6/54例)、150mg群で20.4%(11/54例)に副作用が認められ、また重篤な副作用として白血球減少症が150mg群で1例に認められた。
以上を踏まえ、第Ⅲ相試験における本剤の用法・用量を75mg1日1回投与と設定した。
通常、成人には、ラスクフロキサシンとして1回75mgを1日1回経口投与する。
市中肺炎患者を対象とした第Ⅲ相二重盲検比較試験3)
| 目的 |
市中肺炎患者を対象として、レボフロキサシン500mg1日1回7日間投与に対するラスビック®錠75mg1日1回7日間投与の投与終了7日後の臨床効果の非劣性を検証する。あわせて安全性の検討も行う。 |
|---|---|
| 対象 |
16歳以上80歳未満で日本人市中肺炎患者277例(ラスビック®錠75mg群:140例、レボフロキサシン500mg群:137例) |
| 試験デザイン |
無作為化二重盲検並行群間比較試験 |
| 方法 |
ラスビック®錠75mg群又はレボフロキサシン500mg群に無作為に割付け、1日1回7日間経口投与した。 |
| 評価項目 |
[主要評価項目]投与終了7日後の臨床効果(治癒率) |
| 解析計画 |
[主要評価項目] |
各評価項目の算出方法
- 治癒率(%)=【治癒の例数】/【「治癒+治癒せず」の例数】×100
- 有効率(%)=【有効の例数】/【「有効+無効」の例数】×100
- 菌消失率(%)=【「消失+推定消失」の例数】/【「消失+推定消失+存続+推定存続」の例数】×100
微生物学的効果の判定基準2)
| 消失 | 適切に採取された検体から、当該抗菌薬の投与後に原因菌が検出されなかった場合。 |
|---|---|
| 推定消失 | 治療によって臨床症状が改善または消失し、当初の感染病巣から検査に適した検体が得られなくなった場合、原因菌は消失したものと推定する。 |
| 存続 | 感染病巣から当初の原因菌が検出された場合。 |
| 推定存続 | 臨床症状の改善がみられず、適切に採取された検体からの分離培養が不可能あるいは実施されなかった場合、原因菌は存続していると推定する。 |
| 判定不能 | 種々の理由により微生物学的検査が実施されなかったなど、上述のいずれの判定もできない場合。 |
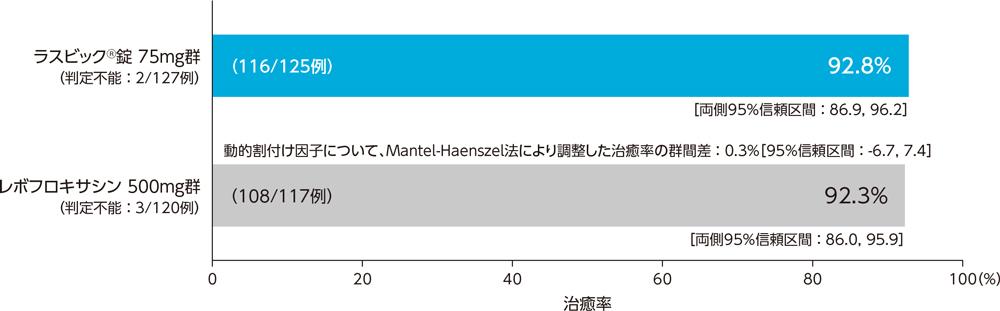
1)投与終了7日後の臨床効果:治癒率(PPS)[主要評価項目]
市中肺炎患者に対する投与終了7日後の臨床効果(治癒率)は、ラスビック®錠75mg群で92.8%、レボフロキサシン500mg群で92.3%であり、群間差の95%信頼区間の下限が−10%を下回らなかったことから、ラスビック®錠75mg群のレボフロキサシン500mg群に対する非劣性が検証された。
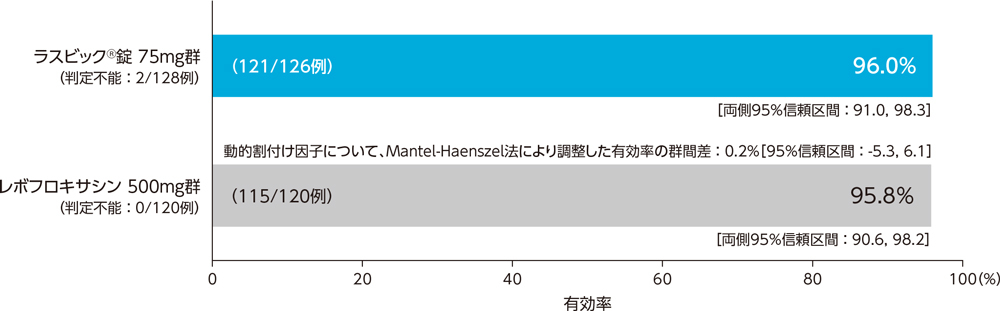
2)投与終了時の臨床効果:有効率(PPS)[副次評価項目]
市中肺炎患者に対する投与終了時の臨床効果(有効率)は、ラスビック®錠75mg群で96.0%、レボフロキサシン500mg群で95.8%であった。
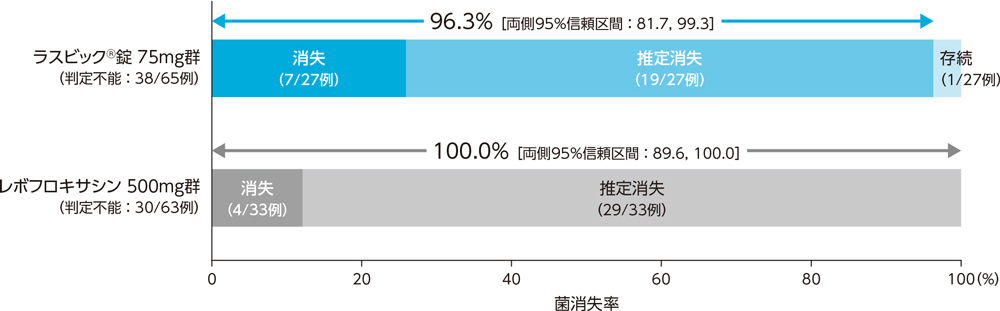
3)投与終了7日後の微生物学的効果:菌消失率(BPPS)[副次評価項目]
市中肺炎患者に対する投与終了7日後の微生物学的効果(菌消失率)は、ラスビック®錠75mg群で96.3%、レボフロキサシン500mg群で100.0%であった。
4)安全性
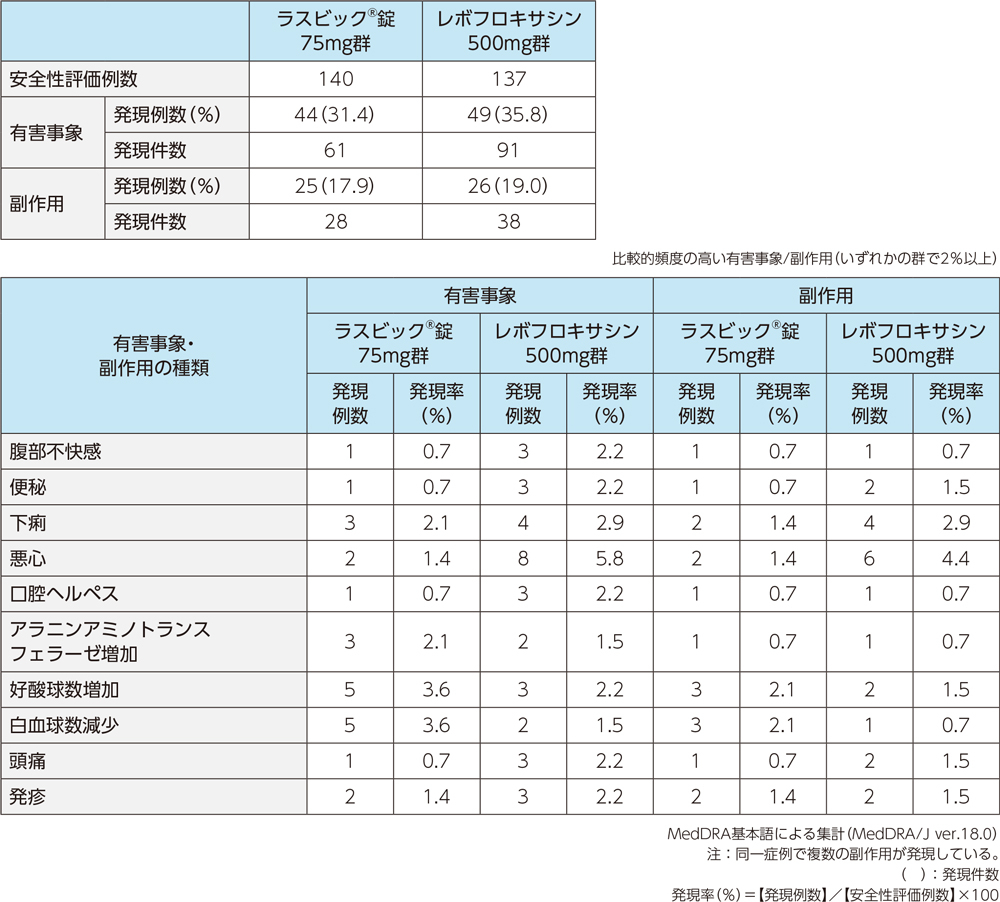
投与中止に至った有害事象は、レボフロキサシン500mg群で3例3件(腎機能検査異常、白血球数減少、蕁麻疹各1例1件)であった。重篤な有害事象は、ラスビック®錠75mg群で2例2件(器質化肺炎、回転性めまい各1例1件)、レボフロキサシン500mg群で4例4件(肺炎2例2件、脱水、器質化肺炎各1例1件)であった。
投与中止に至った副作用(重篤な副作用を除く)は、レボフロキサシン500mg群で3例3件(腎機能検査異常、 白血球数減少、蕁麻疹各1例1件)であった。重篤な副作用は、ラスビック®75mg群で2例2件(器質化肺炎、 回転性めまい各1例1件)であった。
副鼻腔炎患者を対象とした第Ⅲ相二重盲検比較試験4)
| 目的 |
副鼻腔炎患者を対象として、レボフロキサシン500mg1日1回7日間投与に対するラスビック®錠75mg1日1回7日間投与の投与終了時の臨床効果の非劣性を検証する。あわせて安全性の検討も行う。 |
|---|---|
| 対象 |
16歳以上80歳未満の日本人副鼻腔炎患者279例(ラスビック®錠75mg群:140例、レボフロキサシン500mg群:139例) |
| 試験デザイン |
無作為化二重盲検並行群間比較試験 |
| 方法 |
ラスビック®錠75mg群又はレボフロキサシン500mg群に無作為に割付け、1日1回7日間経口投与した。 |
| 評価項目 |
[主要評価項目]投与終了時の臨床効果(有効率) |
| 解析計画 |
[主要評価項目] |
各評価項目の算出方法
- 有効率(%)=【「著効+有効」の例数】/【「著効+有効+やや有効+無効」の例数】×100
- 再燃率(%)=【「やや有効+無効」の例数】/【「著効+有効+やや有効+無効」の例数】×100
- 菌消失率(%)=【「 消失+推定消失+菌交代症」の例数】/【「消失+推定消失+菌交代症+存続+推定存続」の例数】×100
微生物学的効果の判定基準2)
| 消失 | 適切に採取された検体から、当該抗菌薬の投与後に原因菌が検出されなかった場合。 |
|---|---|
| 推定消失 | 治療によって臨床症状が改善または消失し、当初の感染病巣から検査に適した検体が得られなくなった場合、原因菌は消失したものと推定する。 |
| 菌交代症 | 治療により当初の原因菌は消失し、それ以外の当該抗菌薬に感受性を示さない新たな病原微生物が、明らかな感染症の症状や徴候を伴って同じ部位から検出された場合。 |
| 存続 | 感染病巣から当初の原因菌が検出された場合。 |
| 推定存続 | 臨床症状の改善がみられず、適切に採取された検体からの分離培養が不可能あるいは実施されなかった場合、原因菌は存続していると推定する。 |
| 判定不能 | 種々の理由により微生物学的検査が実施されなかったなど、上述のいずれの判定もできない場合。 |
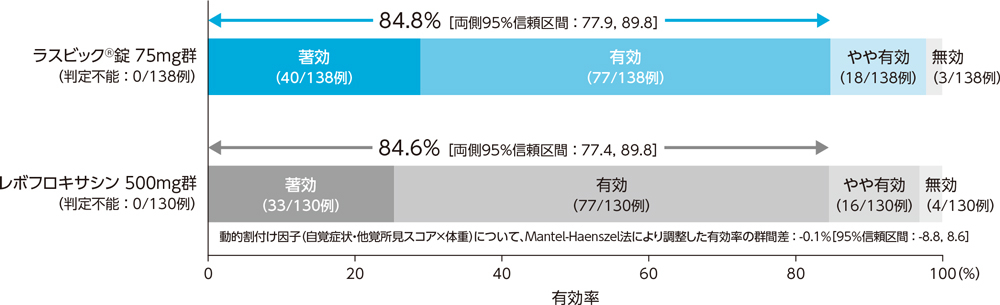
1)投与終了時の臨床効果:有効率(PPS)[主要評価項目]
副鼻腔炎患者に対する投与終了時の臨床効果(有効率)は、ラスビック®錠75mg群で84.8%、レボフロキサシン500mg群で84.6%であり、群間差の95%信頼区間の下限が-10%を下回らなかったことから、ラスビック®錠75mg群のレボフロキサシン500mg群に対する非劣性が検証された。
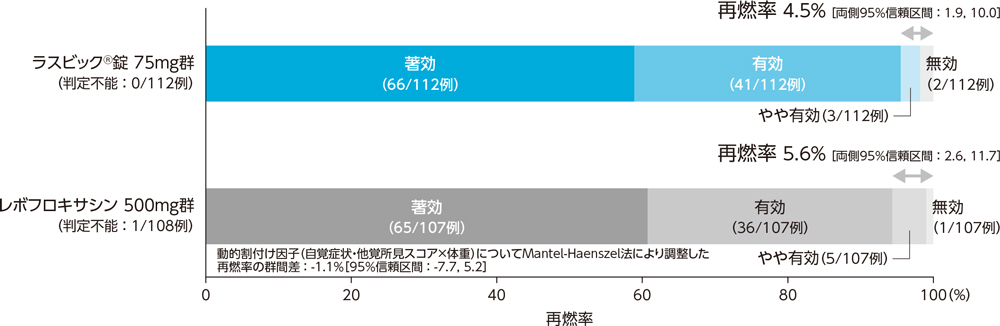
2)投与終了7日後の臨床効果:再燃率(PPS)[副次評価項目]
副鼻腔炎患者に対する投与終了7日後の臨床効果(再燃率)は、ラスビック®錠75mg群で4.5%、レボフロキサシン500mg群で5.6%であった。
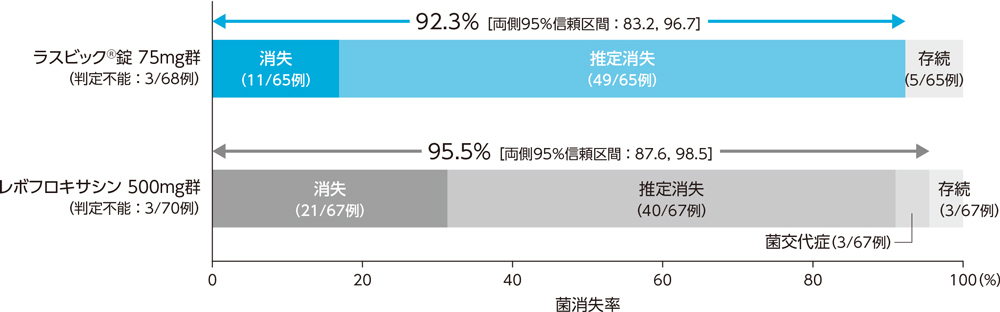
3)投与終了時の微生物学的効果:菌消失率(BPPS)[副次評価項目]
副鼻腔炎患者に対する投与終了時の微生物学的効果(菌消失率)は、ラスビック®錠75mg群で92.3%、レボフロキサシン500mg群で95.5%であった。
4)安全性
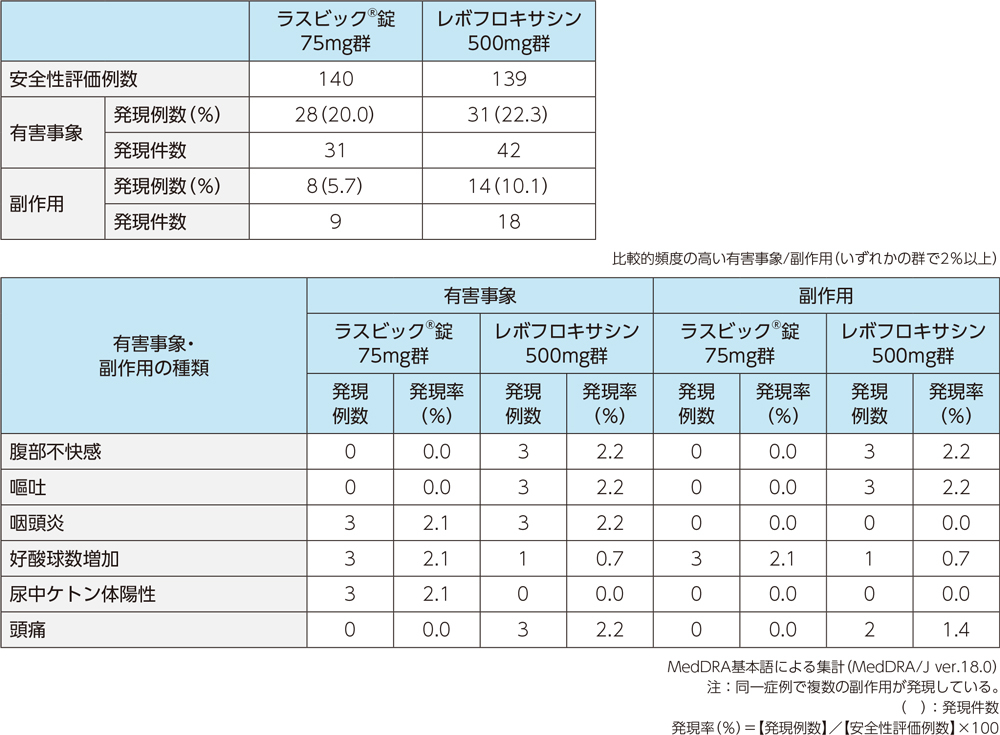
投与中止に至った有害事象は、ラスビック®錠75mg群で2例2件(喘息、白血球数減少各1例1件)、レボフロキサシン500mg群で3例3件(全身性皮疹、頭痛、嘔吐各1例1件)であった。
投与中止に至った副作用は、ラスビック®錠75mg群で2例2件(喘息、白血球数減少各1例1件)、レボフロキサシン500mg群で3例3件(全身性皮疹、頭痛、嘔吐各1例1件)であった。
呼吸器感染症患者を対象とした第Ⅲ相非盲検非対照試験5)
| 目的 |
呼吸器感染症患者を対象として、ラスビック®錠75mg1日1回7日間投与の有効性及び安全性を検討する。 |
|---|---|
| 対象 |
16歳以上の日本人の慢性呼吸器病変の二次感染又は急性気管支炎患者53例(慢性呼吸器病変の二次感染患者:38例、急性気管支炎患者:13例、その他:2例) |
| 試験デザイン |
非盲検非対照試験 |
| 方法 |
ラスビック®錠75mgを1日1回7日間経口投与した。 |
| 評価項目 |
[主要評価項目] |
| 解析計画 |
治癒率、有効率、菌消失率を算出し、その両側95%信頼区間を算出した。 |
各評価項目の算出方法
- 治癒率(%)=【治癒の例数】/【「治癒+治癒せず」の例数】×100
- 有効率(%)=【有効の例数】/【「有効+無効」の例数】×100
- 菌消失率(%)=【「消失+推定消失」の例数】/【「消失+推定消失+存続+推定存続」の例数】×100
微生物学的効果の判定基準2)
| 消失 | 適切に採取された検体から、当該抗菌薬の投与後に原因菌が検出されなかった場合。 |
|---|---|
| 推定消失 | 治療によって臨床症状が改善または消失し、当初の感染病巣から検査に適した検体が得られなくなった場合、原因菌は消失したものと推定する。 |
| 存続 | 感染病巣から当初の原因菌が検出された場合。 |
| 推定存続 | 臨床症状の改善がみられず、適切に採取された検体からの分離培養が不可能あるいは実施されなかった場合、原因菌は存続していると推定する。 |
| 判定不能 | 種々の理由により微生物学的検査が実施されなかったなど、上述のいずれの判定もできない場合。 |
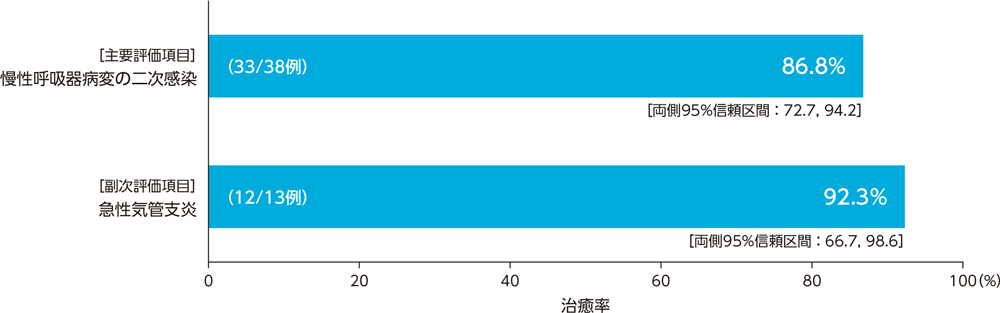
1)投与終了7日後の臨床効果:治癒率(PPS)[主要評価項目、副次評価項目]
呼吸器感染症患者に対する投与終了7日後の臨床効果(治癒率)は、慢性呼吸器病変の二次感染で86.8%、急性気管支炎で92.3%であった。
2)投与終了時の臨床効果:有効率(PPS)[主要評価項目、副次評価項目]
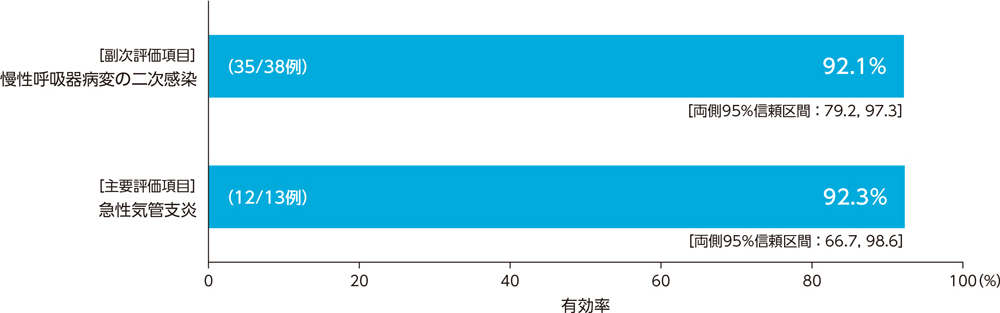
呼吸器感染症患者に対する投与終了時の臨床効果(有効率)は、慢性呼吸器病変の二次感染で92.1%、急性気管支炎で92.3%であった。
3)投与終了7日後の微生物学的効果:菌消失率(BPPS)[副次評価項目]
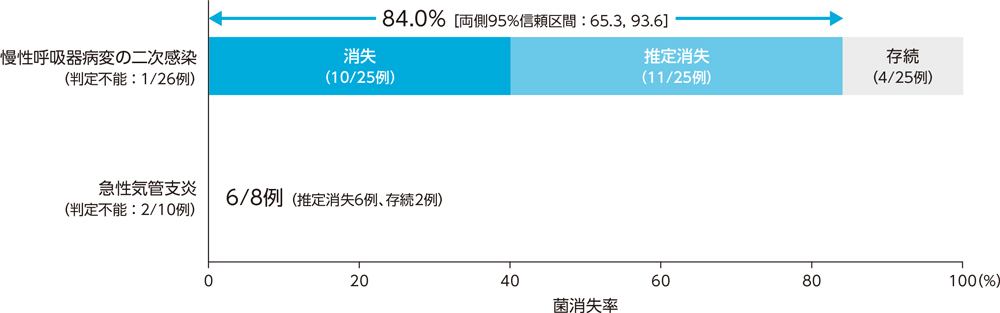
呼吸器感染症患者に対する投与終了7日後の微生物学的効果(菌消失率)は、慢性呼吸器病変の二次感染で84.0%、急性気管支炎で8例中6例であった。
4)安全性
有害事象は53例中16例(30.2%)に認められ、2%以上の被験者に発現した有害事象は悪心、好酸球数増加及び背部痛で、発現割合は各3.8%(2/53例)であった。
副作用は53例中5例(9.4%)5件に認められ、その内訳は腹部膨満、下痢、倦怠感、好酸球数増加、尿中血陽性が各1例(1.9%)であった。
耳鼻咽喉科感染症患者を対象とした第Ⅲ相非盲検非対照試験6)
| 目的 |
耳鼻咽喉科感染症患者を対象として、ラスビック®錠75mg1日1回7日間投与の有効性及び安全性を検討する。 |
|---|---|
| 対象 |
16歳以上の日本人咽頭・喉頭炎、扁桃炎及び中耳炎患者70例(咽頭・喉頭炎:26例、扁桃炎:28例、中耳炎:16例) |
| 試験デザイン |
非盲検非対照試験 |
| 方法 |
ラスビック®錠75mgを1日1回7日間経口投与した。ただし、7日間投与により改善傾向がみられ、有効に作用しつつあり、継続投与すべきと判断された場合には、最長7日間(全体の投与期間として最長14日間)まで延長を可能とした。 |
| 評価項目 |
[主要評価項目]投与終了時の臨床効果(有効率) |
| 解析計画 |
有効率、菌消失率を算出し、その両側95%信頼区間を算出した。 |
各評価項目の算出方法
- 有効率(%)=【「著効+有効」の例数】/【「著効+有効+やや有効+無効」の例数】×100
- 菌消失率(%)=【「消失+推定消失+菌交代症」の例数】/【「消失+推定消失+菌交代症+存続+推定存続」の例数】×100
微生物学的効果の判定基準2)
| 消失 | 適切に採取された検体から、当該抗菌薬の投与後に原因菌が検出されなかった場合。 |
|---|---|
| 推定消失 | 治療によって臨床症状が改善または消失し、当初の感染病巣から検査に適した検体が得られなくなった場合、原因菌は消失したものと推定する。 |
| 菌交代症 | 治療により当初の原因菌は消失し、それ以外の当該抗菌薬に感受性を示さない新たな病原微生物が、明らかな感染症の症状や徴候を伴って同じ部位から検出された場合。 |
| 存続 | 感染病巣から当初の原因菌が検出された場合。 |
| 推定存続 | 臨床症状の改善がみられず、適切に採取された検体からの分離培養が不可能あるいは実施されなかった場合、原因菌は存続していると推定する。 |
| 判定不能 | 種々の理由により微生物学的検査が実施されなかったなど、上述のいずれの判定もできない場合。 |
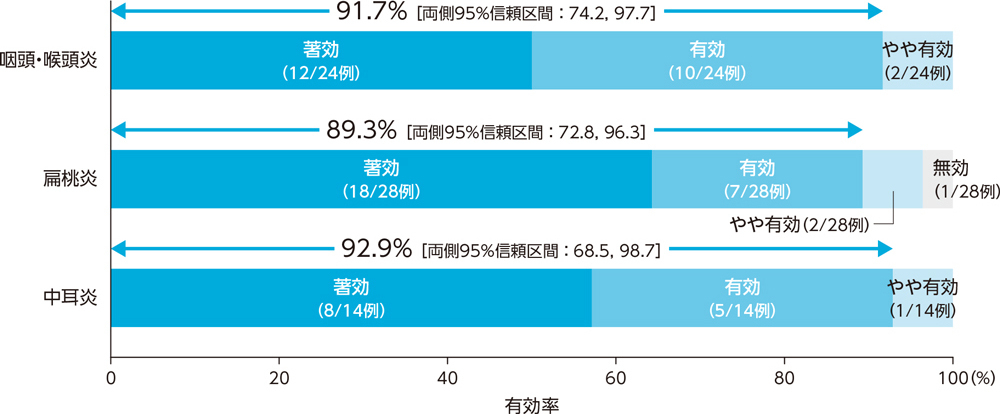
1)投与終了時の臨床効果:有効率(PPS)[主要評価項目]
耳鼻咽喉科感染症患者に対する投与終了時の臨床効果(有効率)は、咽頭・喉頭炎で91.7%、扁桃炎で89.3%、中耳炎で92.9%であった。
2)投与終了7日後の臨床効果:有効率(PPS)[副次評価項目]
耳鼻咽喉科感染症患者に対する投与終了7日後の臨床効果(有効率)は、咽頭・喉頭炎で95.5%、扁桃炎で84.6%、中耳炎で100.0%であった。
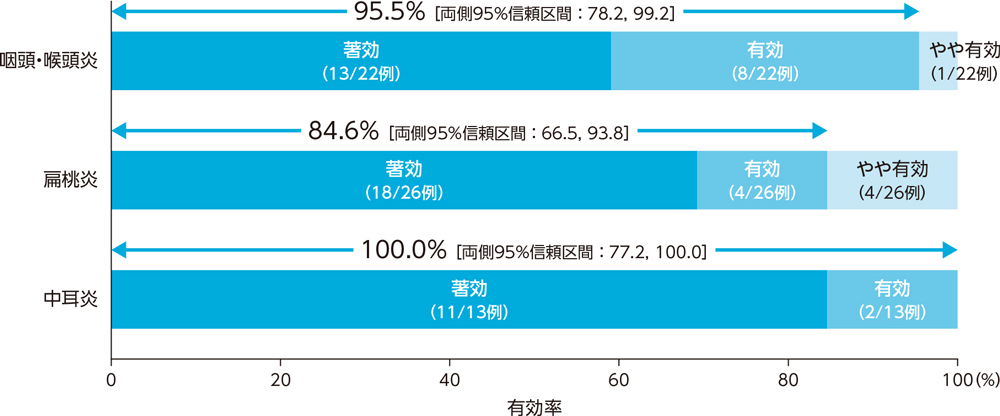
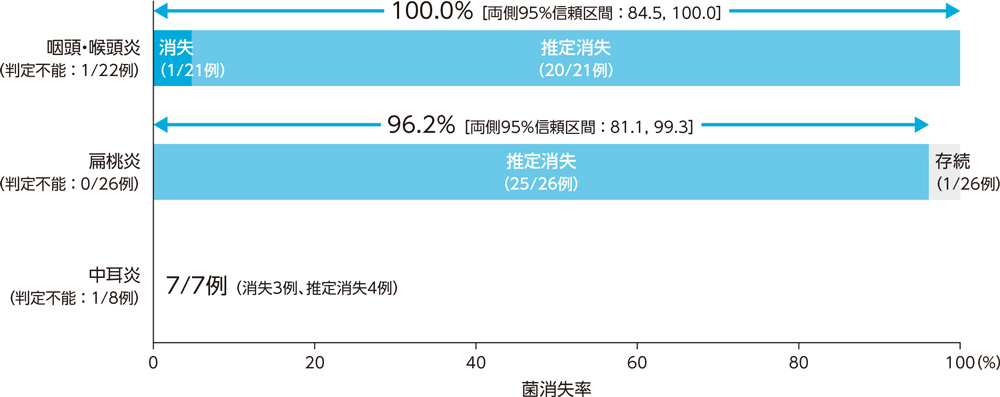
3)投与終了時の微生物学的効果:菌消失率(BPPS)[副次評価項目]
耳鼻咽喉科感染症患者に対する投与終了時の微生物学的効果(菌消失率)は、咽頭・喉頭炎で100.0%、扁桃炎で96.2%、中耳炎で7例中7例であった。
4)安全性
有害事象は17/70例(24.3%)に認められ、2%以上の被験者に発現した有害事象は下痢、血中ビリルビン増加、 尿中蛋白陽性で、発現割合は各2.9%(2/70例)であった。投与中止に至った有害事象は2例2件(異常感、口腔ヘルペス各1例1件)であった。
副作用は70例中6例(8.6%)に認められ、その内訳は下痢が2例(2.9%)、異常感、真菌性耳感染、血中ビリルビン増加、血中ブドウ糖増加が各1例(1.4%)であった。投与中止に至った副作用は1例1件(異常感)であった。
- 1)承認時評価資料:市中肺炎患者を対象とした第Ⅱ相試験(用量設定試験)(AMX-T201試験).
- 2)日本化学療法学会呼吸器感染症における新規抗微生物薬の臨床評価法見直しのための委員会. 呼吸器感染症における新規抗菌薬の臨床評価法(第二版). 日化療会誌, 60(1): 30-45(2012)
- 3)承認時評価資料:市中肺炎患者を対象とした第Ⅲ相二重盲検比較試験(AMX-T301験).
- 4)承認時評価資料:副鼻腔炎患者を対象とした第Ⅲ相二重盲検比較試験(AMX-T303試験).
- 5)承認時評価資料:呼吸器感染症患者を対象とした第Ⅲ相非盲検非対照試験(AMX-T302試験).
- 6)承認時評価資料:耳鼻咽喉科感染症患者を対象とした第Ⅲ相非盲検非対照試験(AMX-T304試験).
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

