-国内第III相長期投与試験-
紹介する結果には承認用量と異なる成績が含まれていますが、承認審査過程で評価された試験成績であるため掲載しています。
100mgは承認外の用量であるため、有効性に関する試験結果はベオーバ50mg維持例の結果のみ記載
社内資料:国内第Ⅲ相長期投与試験(T302試験)[承認時評価資料]
試験概要
| 目的 | 過活動膀胱(OAB)患者を対象にベオーバ50mg(100mgへの増量可能)を52週間長期投与した際の安全性及び有効性を検討する。 |
|---|---|
| 対象 | 20歳以上のOAB患者169例(有効性解析対象例166例、安全性解析対象例167例) |
| 方法 |
多施設共同非盲検非対照試験 観察期後に、ベオーバを52週間経口投与(1日1回朝食後)した。なお、本剤50mgを8週間投与した後、増量基準a)を満たす場合は本剤の用量を100mgに増量し、44週間経口投与(1日1回朝食後)した。 a)増量基準:治療薬の効果が不十分、かつ患者の安全性に問題ないと治験責任医師等が判断し、かつ患者も増量を希望する場合 |
| 安全性評価項目 | 有害事象、臨床検査、バイタルサイン、12誘導心電図検査、残尿量 |
| 有効性評価項目 | 各評価時点におけるベースラインからの変化量(①1日平均排尿回数、②1日平均尿意切迫感回数他)など 評価時点:①、② 4、8、12、24、36、52週 など |
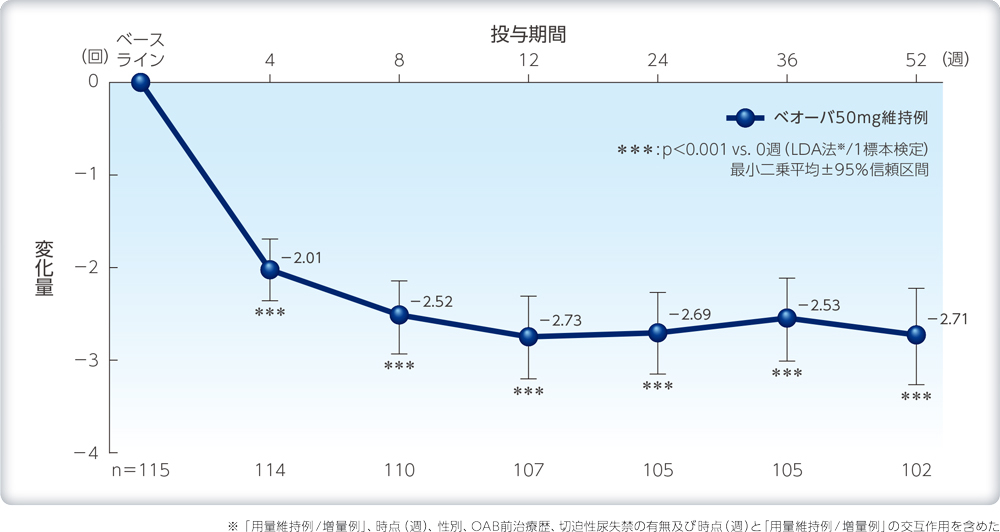
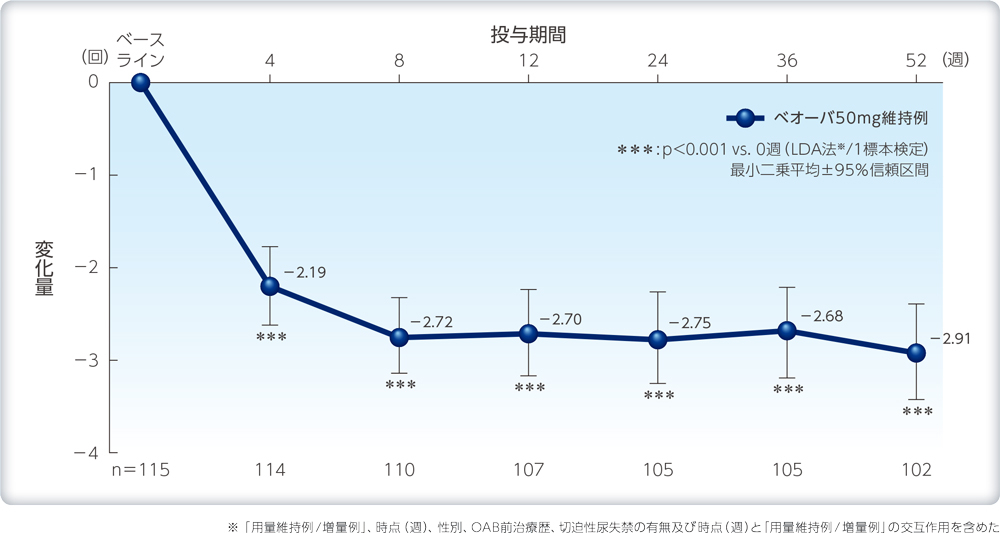
| 解析計画 | 排尿パラメータは、「用量維持例/ 増量例」、時点(週)、性別、OAB前治療歴、切迫性尿失禁の有無及び時点(週)と「用量維持例/ 増量例」の交互作用を含めた経時測定データ解析(LDA法)を用いて、ベースラインからの変化量の最小二乗平均及び両側95%信頼区間の推定、並びに変化量0を帰無仮説とする1標本検定を行った。 |
安全性(安全性解析対象例 167例)
●副作用発現率
| 全体 (n=167) |
ベオーバ50mg維持例 (n=116) |
ベオーバ100mg増量例 (n=51) |
|---|---|---|
| 27 (16.2) | 21 (18.1) | 6 (11.8) |
例数(%)
●主な副作用(発現率1%以上)*
*いずれかの投与群で1%以上
| 全体 | ベオーバ50mg維持例 | ベオーバ100mg増量例 | |
|---|---|---|---|
| 便秘 | 4 (2.4) | 2 (1.7) | 2 (3.9) |
| 口内乾燥 | 5 (3.0) | 3 (2.6) | 2 (3.9) |
| 膀胱炎 | 3 (1.8) | 3 (2.6) | - |
| 残尿量増加 | 5 (3.0) | 5 (4.3) | - |
| 関節リウマチ | 1 (0.6) | - | 1 (2.0) |
| そう痒症 | 1 (0.6) | - | 1 (2.0) |
例数(%)
●重篤な副作用
| ベオーバ50mg維持例 | ベオーバ100mg増量例 |
|---|---|
| 1例1件 | - |
| 脳梗塞 | - |
●投与中止に至った副作用
| ベオーバ50mg維持例 | ベオーバ100mg増量例 |
|---|---|
| 3例3件 | - |
| 脳梗塞1例、残尿量増加2例 | - |
本試験において死亡例は50mg維持例で1例(転倒)に認められたが、本剤との因果関係はなしと判断された。
本剤の承認された用法及び用量は「通常、成人にはビベグロンとして 50mg を1日1回食後に経口投与する。」である。
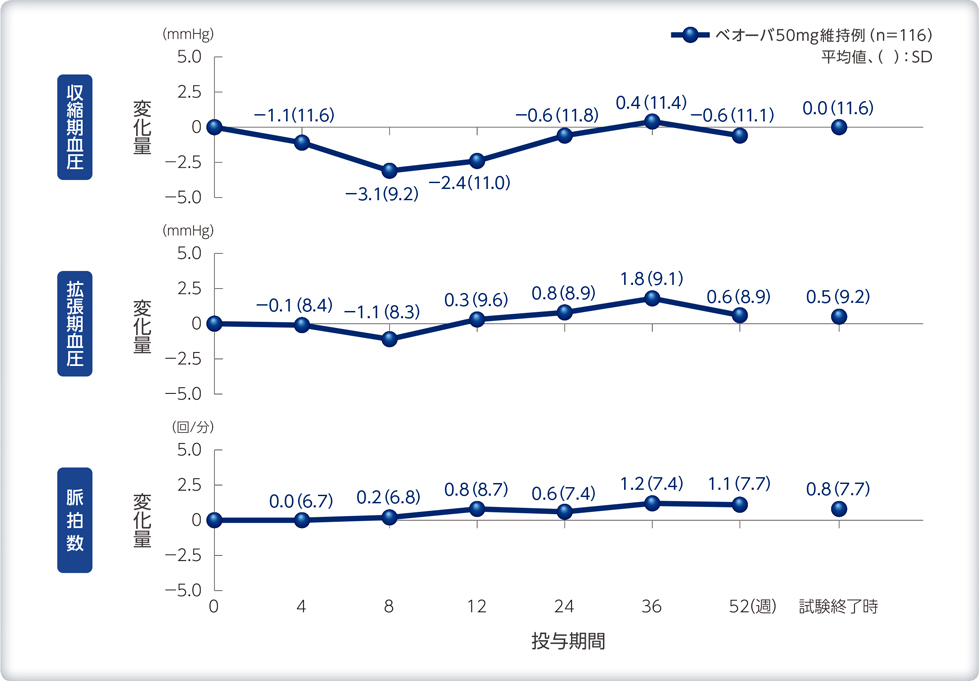
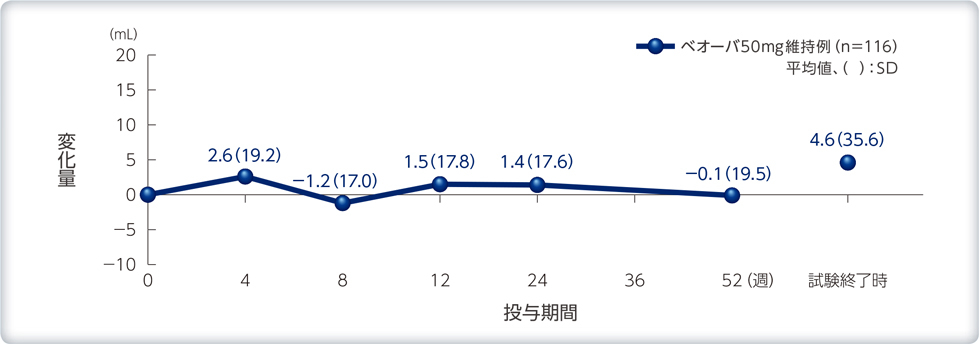
バイタルサイン、残尿量のベースラインからの変化量の推移
バイタルサインへの影響
残尿量への影響
9. 特定の背景を有する患者に関する注意(電子添文抜粋)
9.1 合併症・既往歴等のある患者
9.1.1 重篤な心疾患のある患者
心拍数増加等により、症状が悪化するおそれがある。
1日平均排尿回数のベースラインからの変化量の推移(ベオーバ50mg維持例)
1日平均尿意切迫感回数のベースラインからの変化量の推移(ベオーバ50mg維持例)
本剤の承認された用法及び用量は「通常、成人にはビベグロンとして50mg を1日1回食後に経口投与する。」である。
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。


