-QT/QTc間隔延長に対する影響(海外データ)-
| 対象 | 18歳以上55歳以下の、非喫煙、BMIが32.0kg/m2以下である健康成人男女52例(男女各26例) |
|---|---|
| 方法 |
無作為化二重盲検プラセボ及び陽性対照4群4期クロスオーバー試験 ベオーバ200mg、400mg、モキシフロキサシン400mg(陽性対照)、プラセボのいずれかを空腹時に単回投与した。各期の休薬期間は14日以上とした。 |
| 解析計画 | ベオーバ群とプラセボ群との差の90%信頼区間の上限がすべて10msecを下回る場合、ベオーバ単回投与はその用量では臨床的意義のある程度までQTc間隔を延長しないとの仮説が支持されるものとした。 |
社内資料:海外第Ⅰ相QT/QTc評価試験(012試験)[承認時評価資料]
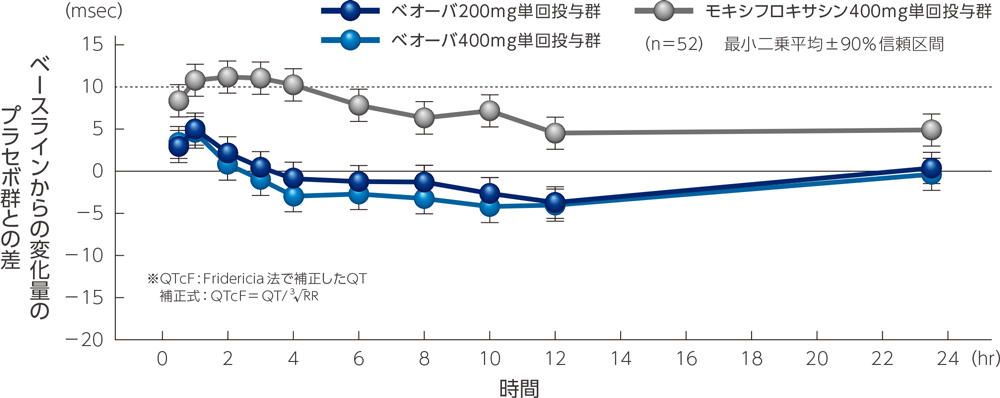
ベオーバ200mg群及び400mg群のQTcFのベースラインからの変化量に対するプラセボ群との差は共に投与後1時間で最大となり、最小二乗平均[90%信頼区間]はそれぞれ4.98msec[3.07, 6.88msec]及び4.60msec[2.71, 6.48msec]でした。
また、ベオーバ投与のすべての時点で差の最小二乗平均の90%信頼区間の上限は10msecを下回りました。
●QTcF※のベースラインからの変化量のプラセボ群との差(最小二乗平均±90%信頼区間)の経時推移
9. 特定の背景を有する患者に関する注意(電子添文抜粋)
9.1 合併症・既往歴等のある患者
9.1.1 重篤な心疾患のある患者
心拍数増加等により、症状が悪化するおそれがある。
本剤の承認された用法及び用量は「通常、成人にはビベグロンとして50mg を1日1回食後に経口投与する。」である。
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。


