-安全性-
安全性薬理試験1)
1. 一般症状及び行動に及ぼす影響(マウス)
メサラジンは100mg/kg、300mg/kgの経口投与において、マウスの一般症状及び行動に影響を及ぼしませんでした。1000mg/kgでは一部の例(6例中1〜4例)で一過性の興奮に伴う反応性の増大と触覚反応、痛覚反応及び耳介反射の亢進が認められましたが、投与後180分には消失し回復が認められました。
2. 中枢神経系に及ぼす影響(マウス、ラット)
マウスの自発運動に対してメサラジン100mg/kg、300mg/kgの経口投与では影響がありませんでしたが、1000mg/kgでは投与後15〜30分に軽度な自発運動量の減少傾向が見られました。メサラジンは1000mg/kgまでの経口投与において、マウスを用いた麻酔作用、抗けいれん作用、けいれん誘発作用、鎮痛作用には影響を及ぼさず、ラットの体温にも影響を及ぼしませんでした。
3. 自律神経系及び平滑筋に及ぼす影響(in vitro)
メサラジンは1×10−6、1×10−5及び1×10−4Mの濃度でウサギの摘出回腸の自動運動に影響を及ぼさず、モルモット摘出回腸でのアセチルコリン、ヒスタミン、塩化バリウムによる収縮にも影響を及ぼしませんでした。
4. 呼吸・循環器系に及ぼす影響(イヌ)
メサラジンは100mg/kg、300mg/kg及び1000mg/kgの十二指腸内投与により、麻酔イヌの呼吸数、血圧、心拍数、大腿動脈血流量、心電図に影響を及ぼしませんでした。
5. 消化器系に及ぼす影響(マウス、ラット)
メサラジンは100mg/kg、300mg/kg及び1000mg/kgの経口投与においてマウスでの小腸輸送能に影響を及ぼさず、ラットでの胃内容物排泄能及び胃液分泌にも影響を及ぼしませんでした。
6. 水及び電解質代謝に及ぼす影響(ラット)
メサラジンは100mg/kgの経口投与ではラットの尿量及び尿中電解質排泄量に影響を及ぼしませんでした。300mg/kgの経口投与では尿中ナトリウム及び塩素イオン排泄量の増加並びに尿量及び尿中カリウムイオン排泄量の増加傾向が認められました。1000mg/kgの経口投与では尿量並びに尿中ナトリウム、カリウム及び塩素イオン排泄量の増加が認められました。
7. その他に及ぼす影響(ラット、in vitro)
メサラジンは100mg/kg、300mg/kg及び1000mg/kgの経口投与ではラットの血液凝固系に影響を及ぼしませんでした。また、メサラジンは1×10−6、1×10−5及び1×10−4Mの濃度でウサギの血小板凝集に影響を及ぼさず、ウサギ赤血球に対しても1×10−6、1×10−5及び1×10−4Mの濃度で溶血作用を示しませんでした。
毒性試験
1. 単回投与毒性(ラット、サル)2)
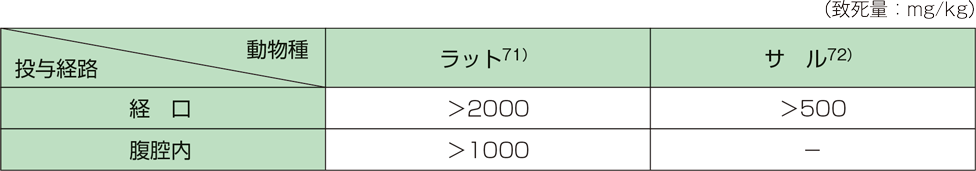
2. 反復投与毒性(ラット、サル)2)
CD系ラットを用いた13週間(休薬13週間)3)及び52週間投与試験、カニクイザルを用いた13週間及び1年間投与試験をそれぞれ経口投与により行いました。いずれの試験においても高用量では腎毒性が認められました。無毒性量はラットでは100〜800mg/kg、カニクイザルでは125〜250mg/kgで、これらは臨床用量のそれぞれ2〜32倍、2.5〜10倍でした。
3. 生殖・発生毒性(ラット、ウサギ)4)
経口投与により、ラットを用いた妊娠前、妊娠期及び授乳期投与試験、ラット及びウサギを用いた器官形成期投与試験、ラットを用いた周産期及び授乳期投与試験を行い、更にラットを用いた器官形成期、周産期及び授乳期投与試験を実施しました。その結果、雌雄の生殖能力、胎児の発育・次世代への影響はなく、催奇形性も認められませんでした。
4. 抗原性(モルモット、マウス)5)
モルモット及びマウスを用いた全身性アナフィラキシー反応(ASA反応)あるいは皮膚アナフィラキシー反応(PCA反応)試験を行いました。いずれの試験においてもメサラジンに抗原性は認められませんでした。
5. 変異原性(in vitro、マウス)6)
大腸菌及びサルモネラ菌を用いた復帰突然変異試験、チャイニーズハムスター肺由来線維芽細胞(CHL/IU)を用いた染色体異常試験、マウスの小核試験を行いました。その結果、変異原性は認められませんでした。
6. がん原性(マウス、ラット)2)
マウス及びラットを用いた混餌投与による104週間がん原性試験を行いました。いずれの動物においてもがん原性を示唆する所見は認められませんでした。
7. 代謝物の単回投与毒性(ラット)2)
CD系ラットを用いて代謝物のN−アセチルメサラジンの静脈内投与による試験を行いました。その結果、致死量は500mg/kg以上でした。
臨床試験(安全性)
1)軽症~中等症の活動期潰瘍性大腸炎に対する第Ⅱ相用量設定試験7)
| 目的 | 軽症~中等症の活動期潰瘍性大腸炎患者を対象としたペンタサ®錠の有効性、安全性ならびにその至適用量の検討 |
|---|---|
| 対象 |
軽症〜中等症の活動期潰瘍性大腸炎60例 (安全性評価対象:54例) |
| 方法 | ペンタサ®錠750mg、1500mgおよび2250mgを1日3回に分けて、4週間経口投与した。 |
| 評価項目 |
|
| 解析計画 | 副作用発現例及び臨床検査値異常変動例については一覧表を作成し、その頻度を集計した。 |
| 安全性 |
副作用は、750mg投与群では腎機能検査異常、便秘、腹痛が各1件認められ、発現率は15.8%(3/19例)でした。2,250mg投与群では肝機能検査異常、下痢、悪心・嘔吐、腹痛、顔面丘疹、胃痛、口内炎が各1件認められ、発現率は26.3%(5/19例)でした。750mg投与群の腹痛と2,250mg投与群の下痢、胃痛、口内炎は中等度で、その他は軽度であり、いずれの症状も投与中止後(投与終了後)または投与継続中に消失しました。投与中止に至った副作用は、750mg投与群では腹痛、便秘が各1件、2,250mg投与群では悪心・嘔吐、下痢が各1件認められました。重篤な副作用及び死亡例は認められませんでした。 臨床検査値異常変動発現率は、750mg投与群では15.8%(3/19例)、1,500mg投与群では6.3%(1/16例)、2,250mg投与群は15.8%(3/19例)でした。薬剤との因果関係が「多分関連あり」の異常変動は、750mg投与群の「尿NAG上昇」、「尿蛋白陽性化」の2件、「関連ないともいえない」の異常変動は、2,250mg投与群の「AST(GOT)上昇」1件であり、これらの異常変動は投与終了後に正常値に回復しました。 |
2)活動期潰瘍性大腸炎に対する用量反応性試験(探索試験):1日2,250mg(分3)投与と4,000mg(分2)投与の比較8)、9)
| 目的 | 活動期潰瘍性大腸炎患者を対象としたペンタサ®2,250mg/日投与とペンタサ®4,000mg/日投与の有効性および安全性についての用量反応性を比較検討 |
|---|---|
| 対象 |
15歳以上65歳未満の初回発作型又は再燃寛解型で、UC-DAIスコア4〜8の活動期潰瘍性大腸炎患者86例(直腸炎型は除く) (安全性評価対象:86例) |
| 方法 | ペンタサ®錠1日2,250mg(分3)又は1日4,000mg(分2;ただし投与回数は1日3回で1回はプラセボ投与)を8週間投与 |
| 評価項目 |
|
| 解析計画 | 副作用発現例についてはその頻度を集計し、95%信頼区間を算出した。 |
| 安全性 |
有害事象は、2,250mg投与群では77.3%(34/44例)、4,000mg投与群では
76.2%(32/42例)に認められました。主な有害事象は、2,250mg投与群では発熱13件、頭痛9件、CRP増加8件、鼻咽頭炎7件、咽喉頭疼痛7件、悪心6件、血中アミラーゼ増加5件、血中鉄減少5件、咳嗽5件などでした。また4,000mg投与群では鼻咽頭炎8件、頭痛8件、発熱5件などでした。 副作用は、2,250mg投与群では27.3%(12/44例)、4,000mg投与群では21.4%(9/42例)に認められました。主な副作用は、2,250mg投与群では血中アミラーゼ増加5件、頭痛4件、発熱2件、CRP増加2件などであり、4,000mg投与群では尿中NAG増加3件などでした。 重篤な副作用は、2,250mg投与群では2例5件に発現し、1例は発熱、CRP増加、他の1例は血中アミラーゼ増加、CRP増加、急性膵炎が認められました。4,000mg投与群では認められませんでした。死亡例は両群とも認められませんでした。 |
3)活動期潰瘍性大腸炎に対する第Ⅲ相用量比較試験(検証試験):再燃寛解型で中等症の活動期潰瘍性大腸炎症例を対象とした1日2,250mg(分3)投与と4,000mg(分2)投与の比較8)、9)
| 目的 | 活動期潰瘍性大腸炎患者を対象としたペンタサ®4,000mg/日投与の2,250mg/日投与に対する優越性の検証、および安全性の比較検討 |
|---|---|
| 対象 |
15歳以上65歳未満の再燃寛解型で、UC-DAIスコア6〜8(中等症)の活動期潰瘍性大腸炎患者123例(直腸炎型は除く) (安全性評価対象:123例) |
| 方法 | ペンタサ®錠1日2,250mg(分3)又は1日4,000mg(分2;ただし投与回数は1日3回で1回はプラセボ投与)を8週間投与。 |
| 評価項目 |
|
| 解析計画 | 副作用発現例についてはその頻度を集計し、95%信頼区間を算出した。 |
| 安全性 |
有害事象は、2,250mg投与群では82.5%(52/63例)、4,000mg投与群では76.7%(46/60例)に認められました。主な有害事象は、2,250mg投与群では鼻咽頭炎21件、CRP増加9件、頭痛7件、リンパ球減少3件などでした。また4,000mg群では鼻咽頭炎19件、尿中NAG増加10件、頭痛7件、CRP増加5件、リンパ球減少5件などでした。 副作用は、2,250mg投与群では25.4%(16/63例)、4,000mg投与群では21.7%(13/60例)に認められました。主な副作用は、2,250mg投与群では尿中NAG増加4件、血小板数増加3件、好酸球増加3件などであり、4,000mg投与群では尿中NAG増加6件、血中ビリルビン増加3件、リンパ球減少2件などでした。重篤な副作用は、4,000mg投与群で2例2件に発現し、1例は鼻咽頭炎、他の1例は潰瘍性大腸炎の悪化が認められました。死亡例は両群とも認められませんでした。 |
4)寛解期潰瘍性大腸炎に対する長期投与試験10)
| 目的 | 寛解期潰瘍性大腸炎患者を対象としたペンタサ®錠の長期間使用での寛解維持効果と安全性についての検討 |
|---|---|
| 対象 | 寛解期潰瘍性大腸炎35例 (安全性評価対象:30例) |
| 方法 | 4週間の観察期間の後、ペンタサ®錠750mg〜2,250mgを1日3回に分けて12ヵ月間経口投与した。 |
| 評価項目 |
|
| 解析計画 | 副作用発現例及び臨床検査値異常変動例については一覧表を作成し、その頻度を集計した。 |
| 安全性 |
副作用発現率は13.3%(4/30例)であり、その内訳は悪心2件、胃部不快感、全身瘙痒感、全身の発疹、肝機能障害、浮腫が各1件の計7件でした。これらの副作用はいずれも軽度であり、投与終了時に症状が消失しなかった1例2件(全身搔痒感及び肝機能障害)を除き、投与中止あるいは投与継続中に消失しました。投与中止に至った副作用は1例2件(全身の発疹、浮腫)でした。重篤な副作用及び死亡例は認められませんでした。 また、臨床検査値異常変動発現率は、16.7%(5/30例)であり、その内訳は、AST(GOT)上昇1件、ALT(GPT)上昇2件、γ-GTP上昇1件、尿中β2-ミクログロブリン上昇1件、尿NAG上昇2件の計7件でした。 |
5)寛解期潰瘍性大腸炎患者を対象とした第Ⅲ相用法用量比較試験(非劣性試験):軽症〜中等症の寛解期潰瘍性大腸炎症例を対象とした1日1回投与と1日3回投与の比較11、12)
| 目的 | 寛解期潰瘍性大腸炎患者を対象としたペンタサ®錠の1日1回投与の1日3回投与に対する非劣性の検証 |
|---|---|
| 対象 | 寛解期潰瘍性大腸炎301例 (安全性評価対象:301例) |
| 方法 |
1日1回投与群(ペンタサ®錠1回1,500mgまたは2,250mg、1日1回投与) 1日3回投与群(ペンタサ®錠1回500mgまたは750mg、1日3回投与) 52週間経口投与 |
| 評価項目 |
|
| 解析計画 | 副作用発現例については一覧表を作成し、その頻度を集計した。 |
| 安全性 |
有害事象は、1日1回投与群では72.4%(110/152例)、1日3回投与群では76.5%(114/149例)に認められました。いずれかの群で発現率が3.0%以上の有害事象は、1日1回投与群では鼻咽頭炎(38.2%)、上気道の炎症(7.9%)、下痢(6.6%)、湿疹(3.9%)、齲歯(3.3%)、1日3回投与群では鼻咽頭炎(38.9%)、下痢(4.0%)、胃腸炎(4.0%)、腹痛(3.4%)でした。 副作用は、1日1回投与群では5.9%(9/152例)、1日3回投与群では4.0%(6/149例)でした。投与量別の副作用は、1,500mg/日では1日1回投与群では鼓腸、手根管症候群、発疹が各1例(2.1%)1件、2,250mg/日 1日1回投与群(105例中)では回転性めまい、悪心、倦怠感、β-Nアセチルグルコサミニダーゼ増加、浮動性めまい、片頭痛、腎結石症、湿疹が各1例(1.0%)1件、1,500mg/日 1日3回投与群(45例中)では胃炎が1例(2.2%)1件、2,250mg/日 1日3回投与群(104例中)では腹部膨満、腹痛、胃炎、γ-グルタミルトランスフェラーゼ増加、筋痙攣、湿疹が各1例(1.0%)1件でした。 |
6)活動期クローン病に対する第Ⅱ相用量設定試験13)
| 目的 | 活動期の成人クローン病を対象としたペンタサ®錠の有効性と安全性ならびにその至適用量の検討 |
|---|---|
| 対象 |
軽症〜中等症の活動期クローン病46例 (安全性評価対象:42例) |
| 方法 | ペンタサ®錠1日1,500mgまたは3,000mg投与の2群に無作為に割付し、1日3回に分けて4週間以上12週間経口投与した。 |
| 評価項目 |
|
| 解析計画 | 副作用発現例及び臨床検査値異常変動例については一覧表を作成し、その頻度を集計した。 |
| 安全性 |
副作用発現率は、1,500mg投与群では0%(0/22例)、3,000mg投与群では10.0%(2/20例)であり、その内訳は胃部不快感の1例1件と悪心・腹痛の1例2件でした。投与中止に至った副作用は、3,000mg投与群の2例であり、重篤な副作用及び死亡例は認められませんでした。 臨床検査値異常変動のうち、薬剤との因果関係が「多分関連あり」の異常変動は、3,000mg/投与群のAST(GOT)上昇、ALT(GPT)上昇の2件、「関連ないともいえない」の異常変動は、1,500mg投与群の尿NAG、AST(GOT)上昇、ALT(GPT)上昇の3件であった。 |
7)寛解期クローン病に対する長期投与試験14)
| 目的 | 寛解期クローン病を対象としたペンタサ®錠の長期間使用での寛解維持効果と安全性についての検討 |
|---|---|
| 対象 | 寛解期のクローン病14例 (安全性評価対象:10例) |
| 方法 | ペンタサ®錠1,500mg〜3,000mgを1日3回に分けて12ヵ月間投与経口投与した。 |
| 評価項目 |
|
| 解析計画 | 発現例及び臨床検査値異常変動例については一覧表を作成し、その頻度を集計した。 |
| 安全性 | 副作用(臨床症状)は認められませんでした。臨床検査値異常変動の発現率は10.0%(1/10例)であり、その内訳は、尿NAG上昇が1例でした。 |
8)サラゾスルファピリジン(SASP)不耐性症例※に対する臨床効果15)
※SASP不耐性症例:
サラゾスルファピリジン不耐性症例とは薬剤過敏症状、肝機能障害などの発現のため、サラゾスルファピリジン継続投与に耐えられない症例
| 目的 | 軽症~中等症の活動期ならびに寛解期の潰瘍性大腸炎におけるSASP不耐性患者を対象としたペンタサ®錠の有効性の検討 |
|---|---|
| 対象 |
軽症ならびに中等症の活動期もしくは寛解期のSASP不耐性の潰瘍性大腸炎23例 ・活動期評価対象:17例 ・寛解期評価対象:8例(治験期間中に活動期から寛解期に移行した5例含む) |
| 方法 | ペンタサ®錠750mg〜2,250mgを1日3回に分けて2週間以上6ヵ月以内で経口投与した。 |
| 評価項目 |
|
| 解析計画 | 副作用発現例及び臨床検査値異常変動例については一覧表を作成し、その頻度を集計した。 |
| 安全性 |

|
特定使用成績調査(安全性)
潰瘍性大腸炎・クローン病(小児)の成績16)
| 目的 | 小児を対象としたペンタサ®錠の製造販売後の使用実態下における安全性および有効性の検討 |
|---|---|
| 対象 |
過去2年間に1度でもペンタサ®錠250mgが投与され、かつ、投与時年齢が15歳未満の潰瘍性大腸炎及びクローン病小児例134例 ※安全性評価対象症例:潰瘍性大腸炎97例、クローン病37例、計134例 |
| 方法 | レトロスペクティブ調査 |
| 安全性 | 副作用は、潰瘍性大腸炎症例では4例(4.5%)7件に発現し、その内訳は、嘔吐、血便、血中アミラーゼ値増加、血中リパーゼ値増加、白血球数減少、好中球数減少、間質性腎炎が各1件認められました。クローン病症例では報告されませんでした。 |
6. 用法及び用量
〈潰瘍性大腸炎〉
通常、成人にはメサラジンとして1日1,500mgを3回に分けて食後経口投与するが、寛解期には、必要に応じて1日1回の投与とすることができる。なお、年齢、症状により適宜増減するが、1日2,250mgを上限とする。
ただし、活動期には、必要に応じて1日4,00mgを2回に分けて投与することができる。
通常、小児にはメサラジンとして1日30~60mg/kgを3回に分けて食後経口投与する。なお、年齢、症状により適宜増減するが、1日2,250mgを上限とする。
〈クローン病〉
通常、成人にはメサラジンとして1日1,500mg~3,000mgを3回に分けて食後経口投与する。なお、年齢、症状により適宜増減する。
通常、小児にはメサラジンとして1日40~60mg/kgを3回に分けて食後経口投与する。なお、年齢、症状により適宜増減する。
7. 用法及び用量に関連する注意
- 7.1 1日4,000mgへの増量は、再燃寛解型で中等症の潰瘍性大腸炎患者(直腸炎型を除く)に対して行うよう考慮すること。
- 7.2 1日4,000mgを、8週間を超えて投与した際の有効性は確立していないため、患者の病態を十分観察し、漫然と1日4,000mgの投与を継続しないこと。
- 7.3 本剤をメサラジン注腸剤又は坐剤と併用する場合には、メサラジンとしての総投与量が増加することを考慮し、特に肝又は腎機能の低下している患者並びに高齢者等への投与に際しては適宜減量するなど、十分に注意すること。併用時に異常がみられた場合には、減量又は中止する等の適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意(一部抜粋)
-
9.1 合併症・既往症等のある患者
9.1.1 サラゾスルファピリジンに対する過敏症のある患者
ペンタサ錠をサラゾスルファピリジンでアレルギー症状がみられた患者に投与したところ、国内の臨床試験で39例中3例(7.7%)、外国において43例中2例(4.7%)に同様のアレルギー症状が認められた。そのため、サラゾスルファピリジンでアレルギー症状がみられた患者に本剤を投与する場合は注意すること。 -
9.7 小児等
専門医の管理下で安全性と治療の有益性を考慮した上で本剤を使用すること。小児等を対象とした臨床試験は実施していない。
- 1)Kotanagi H. et al.:J Gastroenterol 1998;33:571-574
- 2)承認申請添付資料
- 3)木村 均 他:応用薬理 1994;48(4):277-288
- 4)太田隆雄 他:応用薬理 1994;47(6):513-522
- 5)和田 浩 他:応用薬理 1994;47(6):523-528
- 6)永澤佳子 他:応用薬理 1994;48(6):501-509
-
7)棟方昭博 他:薬理と治療 1994;22(Suppl.10)S2509-S2530
利益相反:本研究は杏林製薬株式会社の資金により行われた。 -
8)Hiwatashi N. et al.:J Gastroenterol 2011;46:46-56
利益相反:本研究は杏林製薬株式会社の資金により行われた。 - 9)ペンタサ錠の活動期潰瘍性大腸炎に対する用量比較試験(検証試験:社内資料)
-
10)棟方昭博 他:薬理と治療 1994;22(Suppl.10)S2607-S2624
利益相反:本研究は杏林製薬株式会社の資金により行われた。 -
11)Watanabe M. et al.:Inflamm Bowel Dis 2013;19:1681-1690
利益相反:本研究は杏林製薬株式会社の資金により行われた。 - 12)ペンタサ錠の寛解期潰瘍性大腸炎を対象とした用法用量比較試験(非劣性試験:社内資料)
-
13)棟方昭博 他:薬理と治療 1994;22(Suppl.10)S2531-S2554
利益相反:本研究は杏林製薬株式会社の資金により行われた。 -
14)棟方昭博 他:薬理と治療 1994;22(Suppl.10)S2625-S2638
利益相反:本研究は杏林製薬株式会社の資金により行われた。 -
15)棟方昭博 他:薬理と治療 1994;22(Suppl.10)S2585-S2605
利益相反:本研究は杏林製薬株式会社の資金により行われた。 -
16)豊田 茂 他:日本小児栄養消化器肝臓学会雑誌 2009;23:16-23
利益相反:本研究は杏林製薬株式会社の資金により行われた。
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

