-薬効薬理/製剤学的事項-
薬効薬理
1. QT間隔に対する影響(外国人データ)1)
健康被験者100例にゲーファピキサント10~1800mg又はプラセボの経口懸濁液*を単回経口投与し、ゲーファピキサントのQTc間隔に及ぼす影響を評価しました。
ゲーファピキサント1800mg(45mg 1日2回投与で認められたCmaxの15倍超に相当)まで投与した結果、90%信頼区間の上限値は10msec未満であり、臨床的に意味のあるQTc間隔の延長は認められませんでした。
*本邦で承認されたリフヌアⓇの剤形は錠剤です。
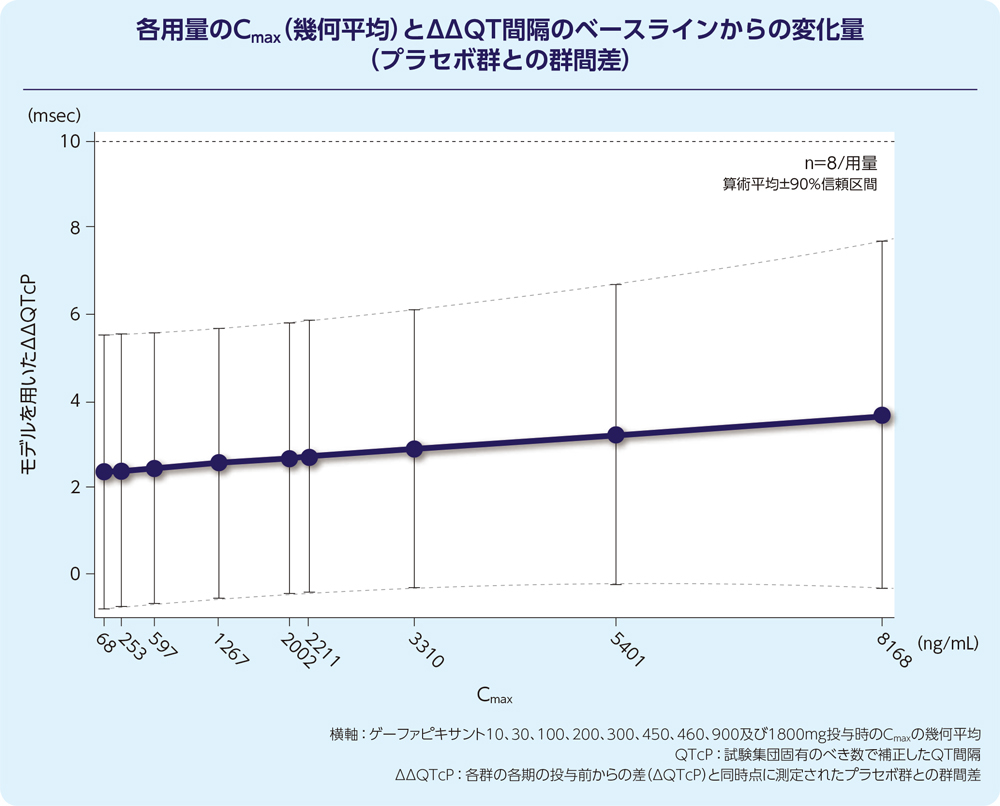
QT/QTc評価試験が陰性とは、その薬剤のQTc間隔への時間を一致させた平均効果の最大値に対する95%片側信頼区間の上限が10msを下回る場合を指すと定義されている。
(日米EU医薬品規制調和国際会議「非抗不整脈薬におけるQT/QTc間隔の延長と催不整脈作用の潜在的可能性に関する臨床的評価」)
- 6.
-
用法及び用量
通常、成人にはゲーファピキサントとして1回45mgを1日2回経口投与する。
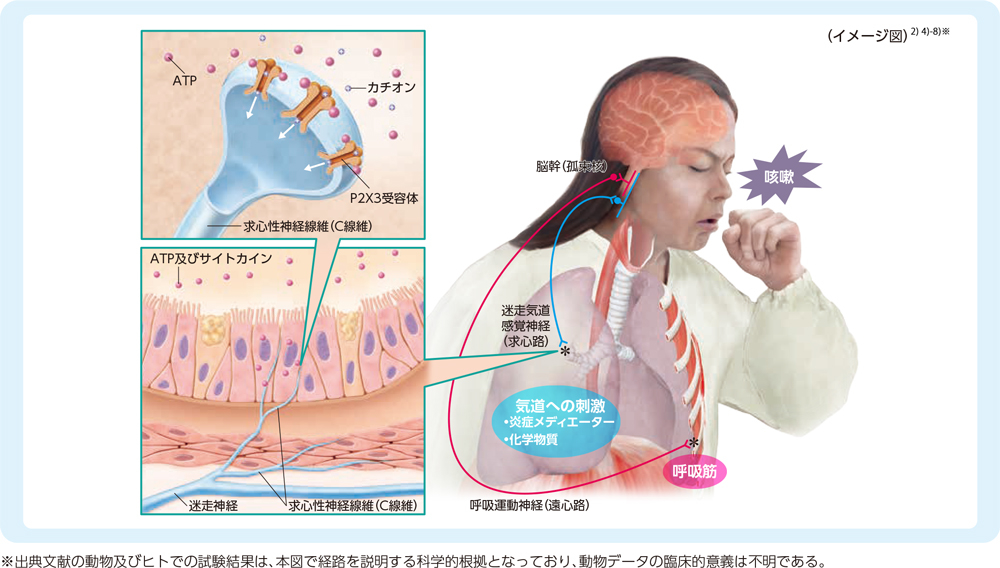
2. P2X3受容体が関与する咳嗽のメカニズム
P2X3受容体は、気道の迷走神経のC線維上にみられるATP依存性イオンチャネルです2)3)。
C線維は炎症又は化学刺激物質に反応して活性化されます。ATPは炎症条件下で気道粘膜細胞から放出されます。
細胞外ATPのP2X3受容体への結合は、C線維による侵害シグナルとして感知されます。C線維の活性化は、患者が
咳嗽の衝動として感じ、咳嗽反射を惹起させます。
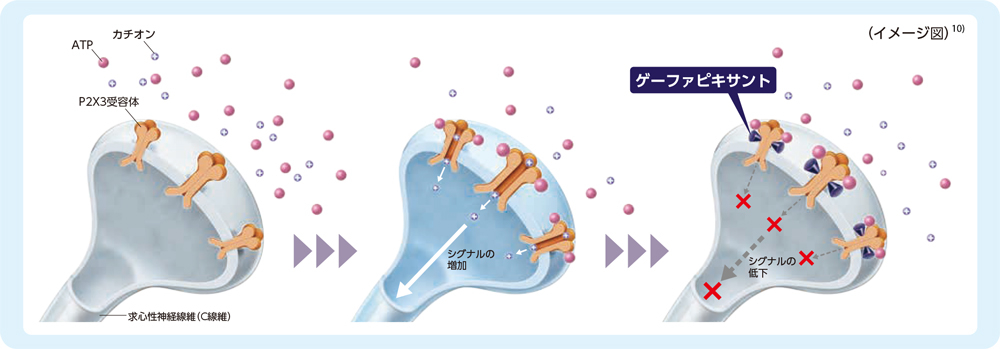
3. ゲーファピキサントの作用機序
ゲーファピキサントは選択的P2X3受容体拮抗薬です9)。
ゲーファピキサントはP2X2/3受容体サブタイプに対する拮抗作用も有しています。
P2X3受容体を介した細胞外ATPシグナル伝達の遮断により、感覚神経の活性化及び咳嗽が抑制されます。
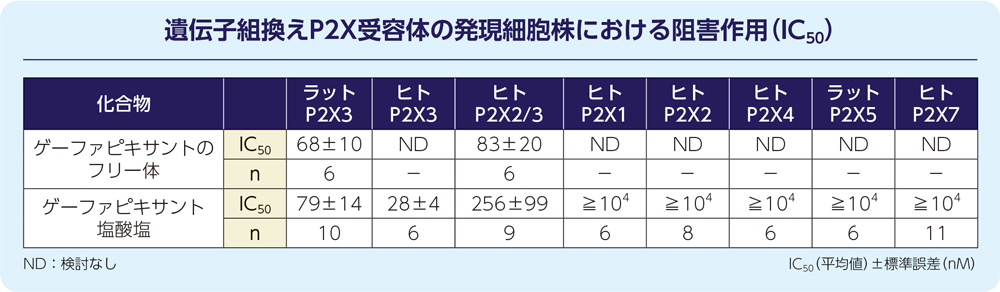
4. 非臨床試験11)
(1)P2X3受容体及びP2X2/3受容体に対する拮抗作用(in vitro)
ゲーファピキサントは、遺伝子組換えのラットP2X3受容体、又はヒトP2X3受容体、及びP2X2/3受容体を発現させた細胞株において、α,β-メチレンアデノシン三リン酸(α,β-MeATP)誘発細胞内カルシウム流出を阻害しました。
本細胞内カルシウム流出データよりゲーファピキサントのヒトP2X3受容体及びヒトP2X2/3受容体におけるIC50値は、それぞれ13~43nM(ゲーファピキサント塩酸塩)及び23~166nM(フリー体)でした。また、ゲーファピキサントの作用は、その他の遺伝子組換えヒトP2X受容体(P2X1、P2X2、P2X4及びP2X7)に対し、検討した10μMまで認められず、P2X3含有受容体に対して選択的でした。
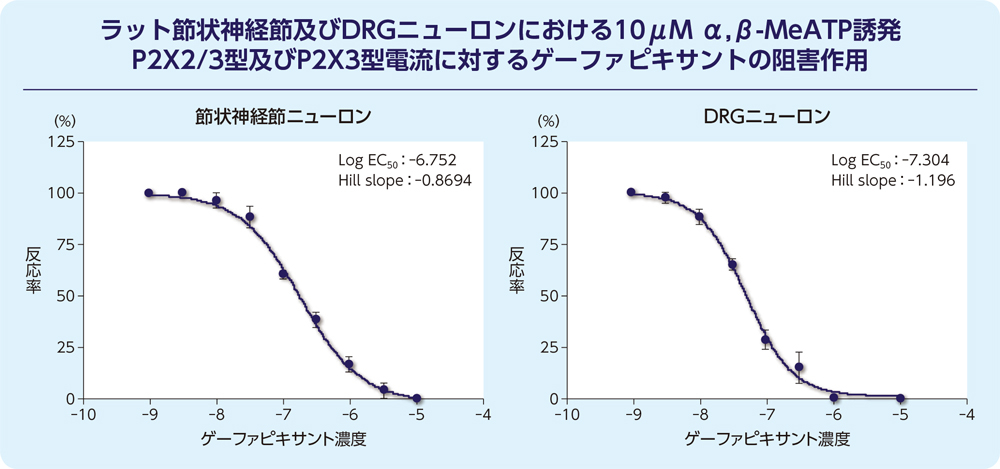
(2)ラット節状神経節及びDRGニューロンにおける一過性P2X2/3型及び持続性P2X3型電流に対する阻害作用(in vitro)
ゲーファピキサントは、ラット摘出節状神経節ニューロン及び脊髄後根神経節(DRG)ニューロンにおいて、一過性P2X3型及び持続性P2X2/3型両方のα,β-MeATP誘発電流を阻害しました。
P2X3型電流阻害のpKi値は、節状神経節ニューロンでは6.9、DRGニューロンでは8.3と算出されました。
(3)P2X3受容体及びP2X2/3受容体との結合親和性(in vitro)
放射性リガンドを用いた競合的結合試験において、ゲーファピキサントのpKi値(平均値±標準偏差)は、ラットP2X3受容体では6.48±0.05、ヒトP2X3受容体では6.58±0.05、ヒトP2X2/3受容体では6.17±0.13でした。
製剤学的事項
(1)製剤の各種条件下における安定性12)
| 試験区分 | 保存条件 | 保存期間 | 保存形態 | 結果 | |
|---|---|---|---|---|---|
| 長期保存試験 | 25℃、60%RH | 36ヵ月 | PTP | 規格内 | |
| 9ヵ月 | 無包装 | 規格内 | |||
| 加速試験 | 40℃、75%RH | 6ヵ月 | PTP | 規格内 | |
| 苛酷試験 | 光 | 25℃、 成り行き湿度条件下 |
総照度として 120万lx・hr以上 及び 総近紫外放射エネルギーとして 200W・h/m2以上 |
無包装 | 対照群(アルミホイルで包んだ試料)と差なし |
取扱い上の注意/包装/関連情報
取扱い上の注意
- 貯 法:
- 室温保存
- 有効期間:
- 48箇月
- 規制区分:
- 処方箋医薬品(注意-医師等の処方箋により使用すること)
包装
100錠[10錠(PTP)×10]
- 1)承認時評価資料:濃度-QTc間隔解析
- 2)Mazzone SB, Undem BJ, Physiol Rev. 2016; 96(3): 975-1024.
-
3)Weigand LA, et al. J Physiol. 2012; 590: 4109-20.
【利益相反】著者のうち1名がMSD社(旧Afferent Pharmaceuticals)の社員である - 4)Keller JA, et al. Chest. 2017; 152(4): 833-41.
-
5)Ford AP, Pain Manag. 2012; 2(3): 267-77.
【利益相反】著者はMSD社(旧Afferent Pharmaceuticals)の社員である - 6)Idzko M, et al. Nat Med. 2007; 13(8): 913-9.
- 7)Polverino M, et al. Multidiscip Respir Med. 2012; 7(1): 5.
- 8)West PW, et al. Am J Respir Crit Care Med. 2015; 192(1): 30-9.
-
9)Richards D, et al. Br J Pharmacol. 2019; 176: 2279-91.
【利益相反】本研究はMSD社の支援によって実施され、著者のうち2名が同社の社員である。 - 10)Wang J, et al. Proc Natl Acad Sci U S A . 2018; 115 (19): 4939-44.
- 11)承認時評価資料:In vitro薬理試験
- 12)承認時評価資料:安定性。
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

