-製品・患者指導情報-
日本標準商品分類番号:87259
医薬品リスク管理計画対象品
べオーバ錠の製品基本情報-Product information-
2.禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
3.組成・性状
3.1 組成
| 有効成分 | 1錠中 ビベグロン50mg |
|---|---|
| 添加剤 | D-マンニトール、結晶セルロース、クロスカルメロースナトリウム、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、乳糖水和物、ヒプロメロース、酸化チタン、トリアセチン、黄色三二酸化鉄、青色2号アルミニウムレーキ、カルナウバロウ |
3.2 製剤の性状
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 淡緑色 |
| 外形 |
 直径:約6.5mm 厚さ:約3.5mm 質量:約105mg |
4.効能又は効果
過活動膀胱における尿意切迫感、頻尿及び切迫性尿失禁
5.効能又は効果に関連する注意
- 5.1
- 本剤を適用する際、十分な問診により臨床症状を確認するとともに、類似の症状を呈する疾患(尿路感染症、尿路結石、膀胱癌や前立腺癌などの下部尿路における新生物等)があることに留意し、尿検査等により除外診断を実施すること。なお、必要に応じて専門的な検査も考慮すること。
- 5.2
- 下部尿路閉塞疾患(前立腺肥大症等)を合併している患者では、それに対する治療を優先させること。
6.用法及び用量
通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。
9.特定の背景を有する患者に関する注意
- 9.1
- 合併症・既往歴等のある患者
- 9.1.1
-
重篤な心疾患のある患者
心拍数増加等により、症状が悪化するおそれがある。 - 9.3
- 肝機能障害患者
- 9.3.1
-
高度の肝機能障害のある患者
血中濃度が上昇するおそれがある。[16.6.2参照] - 9.5
-
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)において胎児への移行が報告されている。 - 9.6
-
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)において乳汁中に移行することが報告されている。 - 9.7
-
小児等
小児等を対象とした臨床試験は実施していない。 - 9.8
-
高齢者
患者の状態を十分に観察しながら慎重に投与すること。一般に生理機能が低下している。[16.6.3参照]
10.相互作用
ビベグロンはCYP3A4又はP-糖タンパク(P-gp)の基質であることが示唆されている。
10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
|
ケトコナゾールと併用したとき、ビベグロンの血中濃度が上昇したとの報告がある。 | CYP3A4及びP-gpを阻害する薬物と併用することにより、ビベグロンの血中濃度が上昇する可能性がある。 |
|
フェニトイン カルバマゼピン |
ビベグロンの作用が減弱する可能性がある。 | CYP3A4及びP-gpを誘導する薬物と併用することにより、ビベグロンの血中濃度が低下する可能性がある。 |
11.副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1 重大な副作用
- 11.1.1
- 尿閉(頻度不明)
11.2 その他の副作用
| 1~2%未満 | 1%未満 | 頻度不明 | |
|---|---|---|---|
| 精神神経系 | 頭痛、めまい、不眠症、傾眠 | ||
| 消化器 | 口内乾燥、便秘 | 悪心、腹部膨満、消化不良、胃炎、胃食道逆流性疾患、下痢、腹痛、食欲減退 | |
| 循環器 | QT延長、動悸 | ||
| 泌尿器・腎臓 | 尿路感染(膀胱炎等)、残尿量増加 | 排尿躊躇、膀胱痛、遺尿、排尿困難 | |
| 皮膚 | 発疹、多汗症、そう痒症 | ||
| 眼 | 羞明 | 眼乾燥、霧視 | |
| 肝臓 | AST上昇、ALT上昇 | 肝機能異常、γ-GTP上昇、Al-P上昇 | |
| その他 | 疲労、ほてり、高脂血症、体液貯留、筋肉痛、浮腫、CK上昇、口渇、血圧上昇、胸部不快感 |
14.適用上の注意
- 14.1
-
薬剤交付時の注意
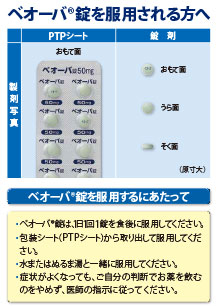
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
21.承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22.包装
100錠[10錠(PTP)×10]
140錠[14錠(PTP)×10]
ベオーバ錠の特性-Characteristic-
01POINT
β3アドレナリン受容体を選択的に刺激し、膀胱平滑筋を弛緩させ(in vitro)、膀胱容量を増大しました(カニクイザル)。
02POINT
過活動膀胱における尿意切迫感、頻尿、切迫性尿失禁に対し、1日1回投与で有効性を示しました。
03POINT
QOLの指標となったキング健康調査票の全ての項目を改善しました。
04POINT
52週投与まで尿意切迫感、頻尿、切迫性尿失禁に対する有効性は維持されました。
05POINT
重大な副作用として尿閉が報告されています(頻度不明)。
主な副作用(発現頻度1~2%未満)は、口内乾燥、便秘、尿路感染(膀胱炎 等)、残尿量増加が報告されています。
電子添文の副作用の項及び臨床成績の項の安全性の結果をご参照下さい。
主な副作用(発現頻度1~2%未満)は、口内乾燥、便秘、尿路感染(膀胱炎 等)、残尿量増加が報告されています。
電子添文の副作用の項及び臨床成績の項の安全性の結果をご参照下さい。