-薬物動態-
<臨床的に意味のある影響がみられない曝露量の変動許容範囲>
第Ⅲ相試験(027試験及び030試験)の結果より変動許容範囲の下限値として45mg
1日2回投与時の定常状態時のAUCの5%点を採用した。
このAUCの5%点(2710ng·hr/mL)は、予測される45mg
1日2回投与時のAUCの幾何平均(4144ng·hr/mL)の0.7倍に相当する。
第Ⅰ相、第Ⅱ相及び第Ⅲ相試験でのゲーファピキサントの臨床使用経験から、45mg
1日2回投与時のAUCを基準とした際の変動許容範囲の上限を2倍(AUCは8288ng·hr/mLに相当)に設定した。
1. 血中濃度
(1)単回投与1)
健康成人男性14例にゲーファピキサント50mgを空腹時単回経口投与した際の血漿中ゲーファピキサントの濃度推移及び薬物動態パラメータは以下のとおりでした。
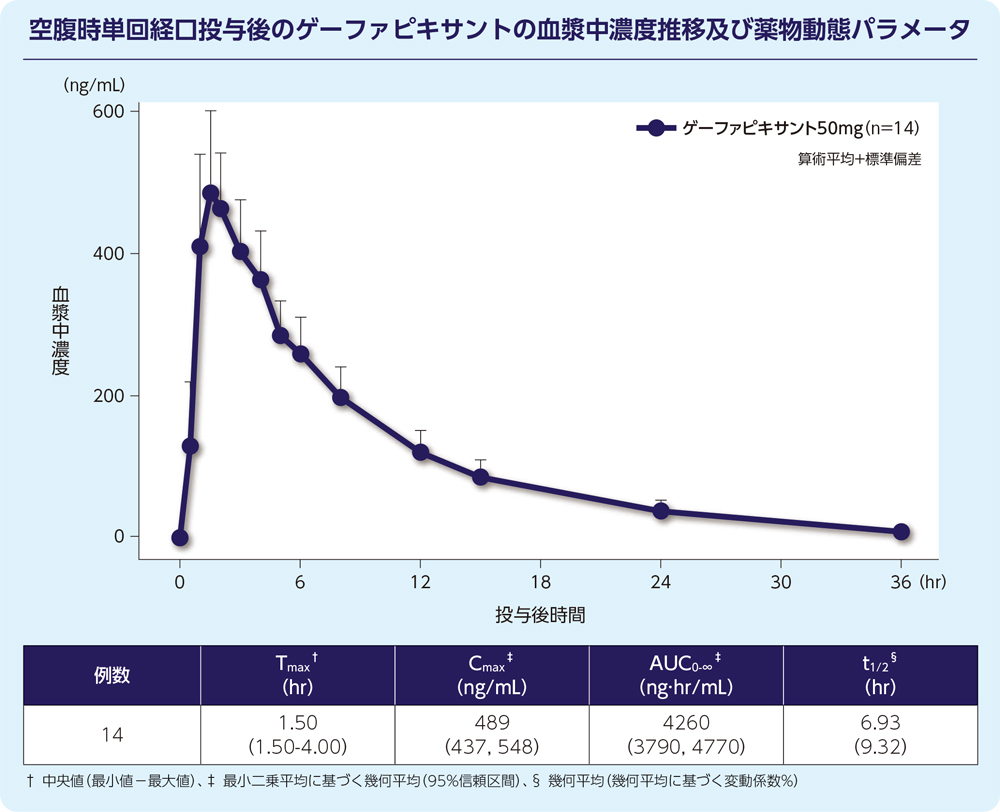
- 4.
-
効能又は効果
難治性の慢性咳嗽
- 6.
-
用法及び用量
通常、成人にはゲーファピキサントとして1回45mgを1日2回経口投与する。
(2)反復投与
1)健康成人1)
健康成人男性にゲーファピキサント15、30、50mgを食後に1日2回15日間反復経口投与(15日目は朝投与のみ)した際、血漿中ゲーファピキサント濃度は投与後3日目までに定常状態に到達し、AUC0-12hr及びCmaxに基づく累積係数は1.21~1.49でした。
15~50mgの用量範囲で1日2回反復経口投与したとき、AUC0-12hr及びCmaxは用量比例性を示しました。
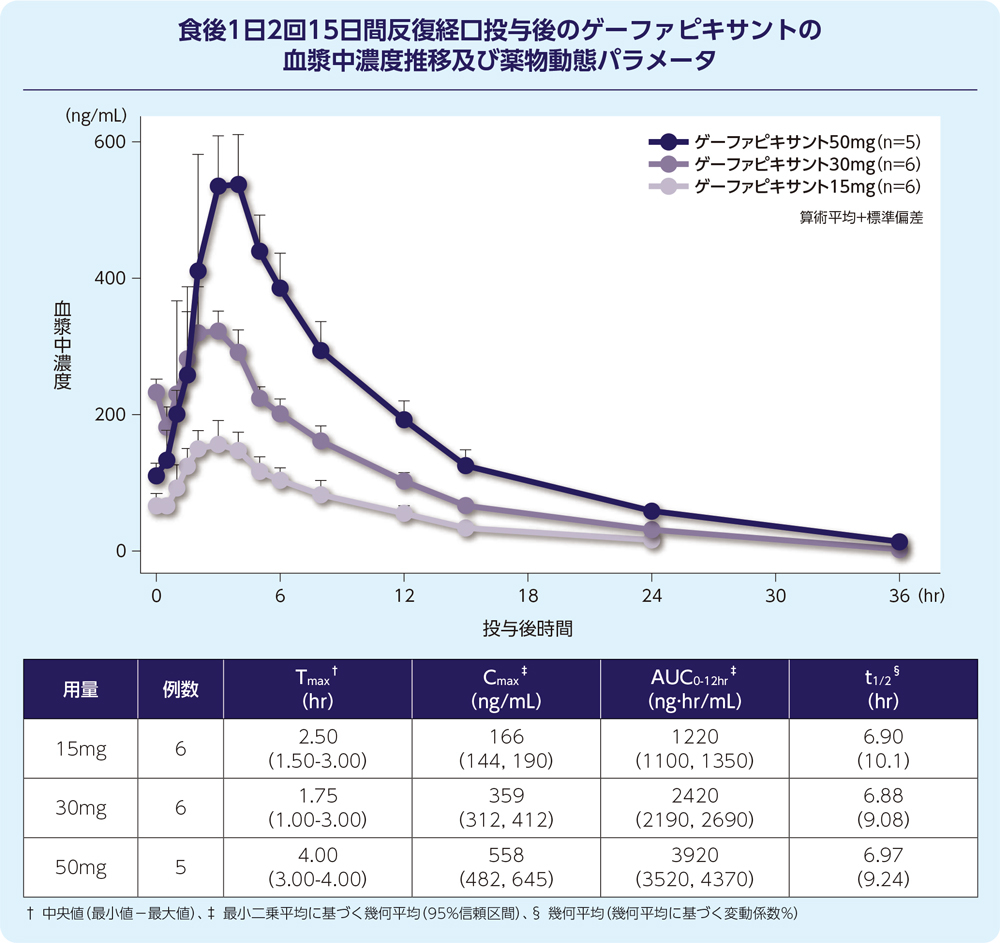
2)難治性又は原因不明の慢性咳嗽患者2)
プラセボを対照とした国際共同第Ⅲ相試験(027試験)の母集団薬物動態解析の結果、日本人難治性又は原因不明の慢性咳嗽患者14例にゲーファピキサント45mgを1日2回反復経口投与したときの定常状態における血漿中AUC0-12hr及びCmaxの幾何平均は、それぞれ3832ng·hr/mL及び538ng/mLでした。
(3)食事の影響1)
健康成人男性14例にゲーファピキサント50mgを空腹時及び高脂肪食摂取後に単回経口投与した際、ゲーファピキサントのAUC0-∞及びCmaxに対する臨床的に意味のある食事の影響は認められませんでした。
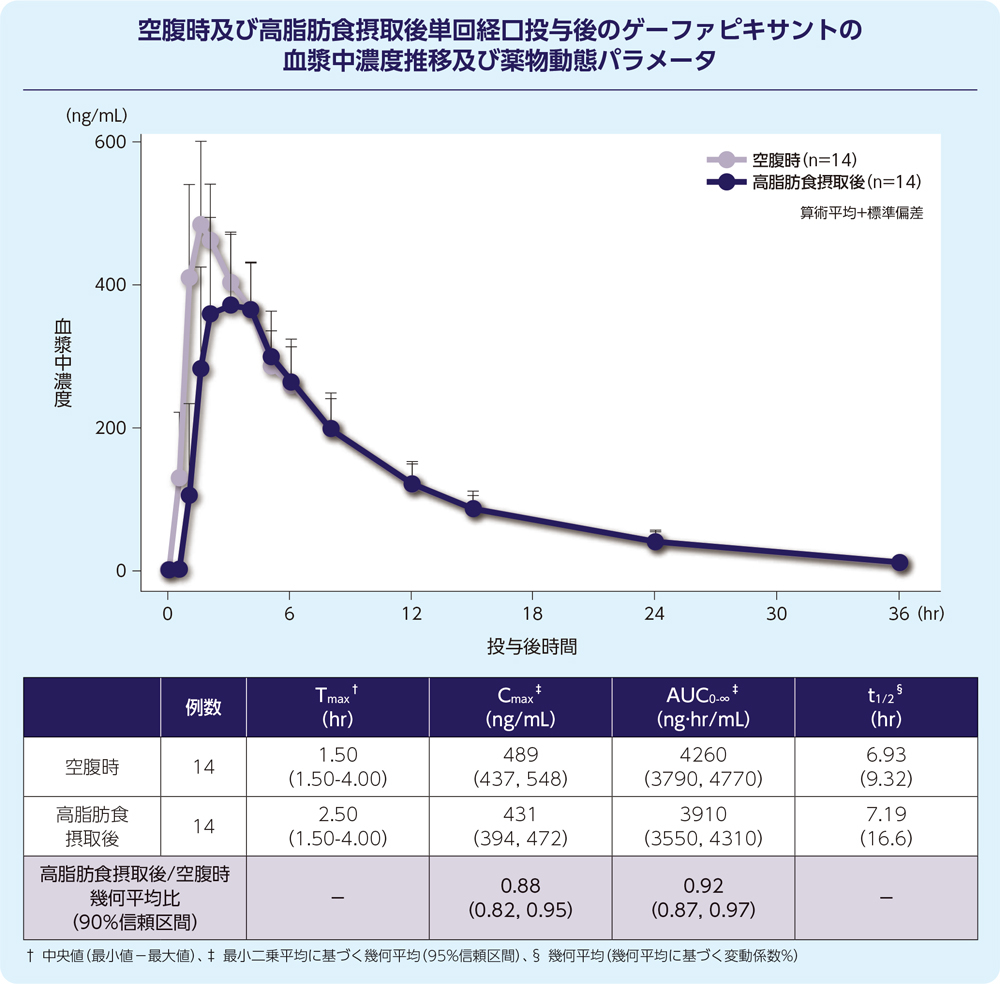
- 6.
-
用法及び用量
通常、成人にはゲーファピキサントとして1回45mgを1日2回経口投与する。
- 7.
-
用法及び用量に関連する注意
重度腎機能障害(eGFR 30mL/min/1.73m2未満)で透析を必要としない患者には、本剤45mgを1日1回投与すること。[9.2、9.2.1、9.8、電子添文 16.6.1参照]
- 9.
- 特定の背景を有する患者に関する注意(抜粋)
- 9.2
-
腎機能障害患者
腎機能検査を定期的に実施することが望ましい。なお、味覚異常は曝露量依存的に増加する傾向が認められている。[7.、9.8、15.1.1、15.2参照]
- 9.2.1
-
重度腎機能障害(eGFR
30mL/min/1.73m2未満)で透析を必要としない患者
ゲーファピキサントの曝露量の上昇が認められた。[7.、9.8、電子添文16.6.1参照]
- 9.2.2
-
透析を必要とする末期腎不全患者
推奨される用法及び用量の調節を設定するための十分なデータは得られていない。[13.1参照]
(4)腎機能障害(外国人データを含む)3)
軽度又は中等度腎機能障害(eGFR
30mL/min/1.73m2以上)はゲーファピキサントの曝露量に対して臨床的に意味のある影響を及ぼしませんでした。
治療抵抗性又は原因不明の慢性咳嗽患者を含めた母集団薬物動態解析の結果、重度腎機能障害(eGFR
30mL/min/1.73m2未満)で透析を必要としない患者では腎機能正常者と比較し、ゲーファピキサントのAUC0-12hr及びCmaxの幾何平均はそれぞれ89%及び54%増加すると予測されました。
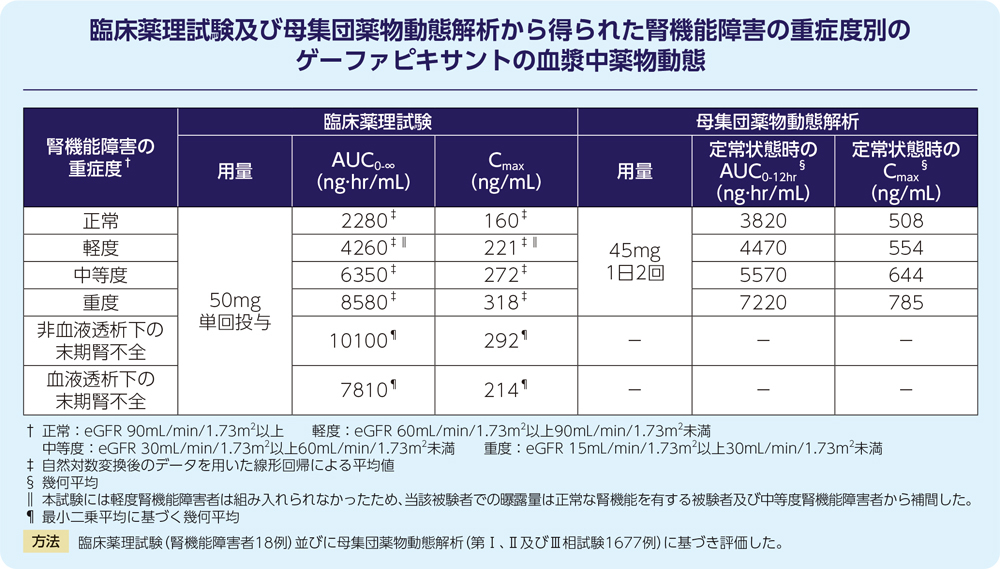
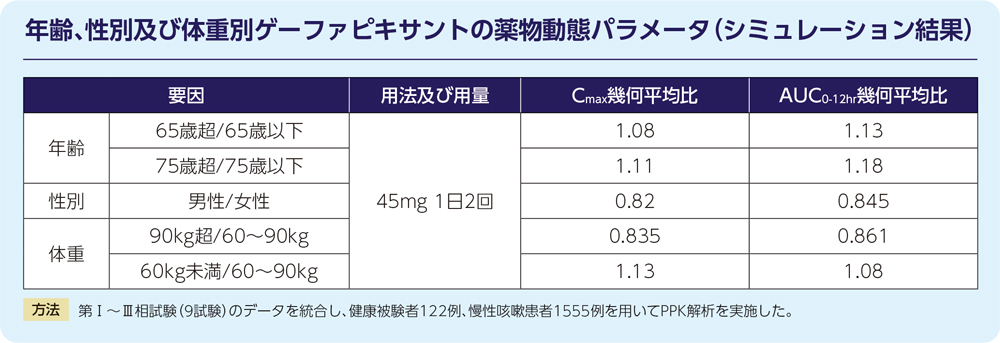
(5)年齢、性別、人種、体重(外国人データを含む)4)
年齢、性別、人種及び体重はゲーファピキサントの薬物動態に対して臨床的に意味のある影響を及ぼしませんでした。

2. 吸収
(1)吸収率(外国人データ)5)
健康成人男性6例に14C標識ゲーファピキサント50mgを単回経口投与したときのゲーファピキサントの吸収率は78%以上でした。
3. 分布
(1)分布容積6)
母集団薬物動態解析に基づき、ゲーファピキサント45mgを1日2回反復経口投与した際の定常状態における見かけの分布容積の平均は138Lと推定されました。
(2)蛋白結合率(in vitro)6)
ゲーファピキサントのヒト血漿蛋白結合率は低く(55%)、血液/血漿濃度比は1.1でした。
(3)中枢神経系への移行性(ラット)7)
ラットに90mg/kgを単回経口投与、30mg/kgを皮下投与、又は62.3mg/kgを8時間静脈内注入したときの脳/血漿中濃度比は約0.05、中枢神経系/血漿中非結合型濃度比は約0.1であり、中枢神経系への移行性は低いことが確認されました。
4. 代謝(外国人データ)5)
ゲーファピキサントの消失における代謝の寄与は小さく、チトクロムP450(CYP)又はUDP-グルクロノシルトランスフェラーゼ(UGT)の阻害剤又は誘導剤との併用により臨床的に意味のある薬物相互作用が生じる可能性は低いと考えられます。
健康成人男性6例に14C標識ゲーファピキサント50mgを単回経口投与した際、血漿中の主成分は未変化体であり(87%)、血漿中代謝物は投与放射能の10%未満でした。
5. 排泄(外国人データ)5)
ゲーファピキサントの主要な消失経路は腎排泄であり、全身クリアランスにおける尿細管分泌クリアランスの寄与は約46%と推定されています。
健康成人男性6例に14C標識ゲーファピキサント50mgを単回経口投与したとき、投与放射能に対し、尿中には未変化体が約64%及び代謝物が約12%、糞中には未変化体が約20%及び代謝物が約2%排泄されました。
6. 薬物相互作用
(1)in vitro試験8)
ゲーファピキサントは排出トランスポーターである多剤・毒素化合物排出蛋白(MATE)1、MATE2-K、P-糖蛋白(P-gp)及び乳癌耐性蛋白(BCRP)の基質でした。
ゲーファピキサントがCYPを阻害又は誘導する可能性は低いため、CYPによって代謝される薬剤に影響を及ぼさないと考えられます。ゲーファピキサントはMATE1、MATE2-K、有機カチオントランスポーター(OCT)1、有機アニオン輸送ポリペプチド(OATP)1B1及びOATP1B3に対して阻害作用を示しました。
(2)臨床薬物相互作用試験(外国人データ)
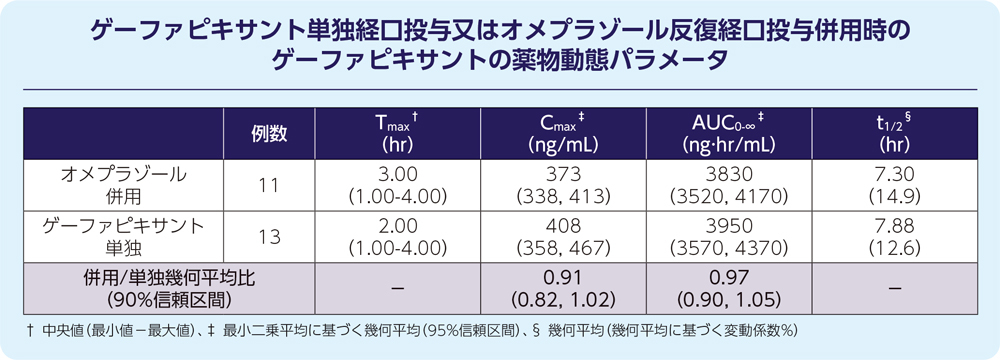
1)オメプラゾール9)
健康被験者14例にゲーファピキサント50mg(単回経口投与)及びプロトンポンプ阻害剤であるオメプラゾール40mg(1日1回5日間反復経口投与)を併用したとき、ゲーファピキサントの薬物動態に対して臨床的に意味のある影響は認められませんでした。
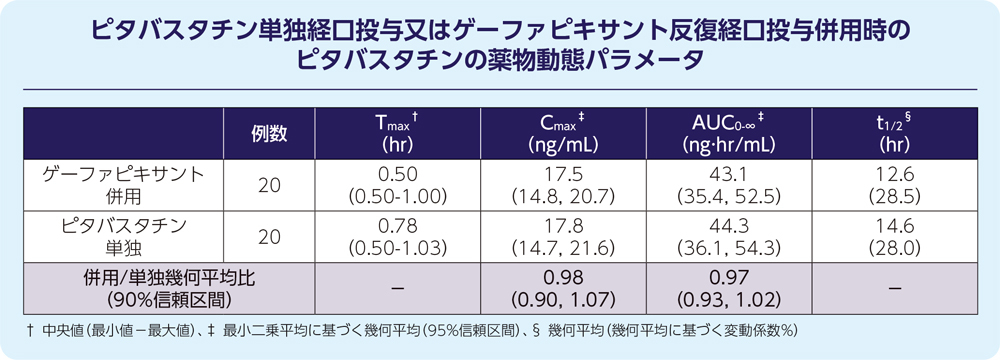
2)ピタバスタチン10)
健康被験者20例にゲーファピキサント45mg(1日2回4日間反復経口投与)及びOATP1Bの基質であるピタバスタチン1mg(単回経口投与)を併用したとき、ピタバスタチンの薬物動態に対して臨床的に意味のある影響は認められませんでした。
- 6.
-
用法及び用量
通常、成人にはゲーファピキサントとして1回45mgを1日2回経口投与する。
- 1) 承認時評価資料:日本人健康被験者を対象とした単回及び反復投与試験(024試験)
- 2) 承認時評価資料:人種
- 3) 承認時評価資料:腎機能障害
- 4) 承認時評価資料:年齢、性別、人種、体重
- 5) 承認時評価資料:非日本人健康被験者を対象としたマスバランス試験(028試験)
- 6) 承認時評価資料:分布及び蛋白結合
- 7) 承認時評価資料:非臨床薬物動態試験
- 8) 承認時評価資料:In vitro トランスポーター試験
- 9) 承認時評価資料:非日本人健康被験者を対象とした相対的バイオアベイラビリティ、食事の影響及び薬物相互作用試験(025試験)
- 10) 承認時評価資料:非日本人健康被験者を対象としたピタバスタチンとの薬物相互作用試験(044試験)
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

