-臨床成績 潰瘍性大腸炎〈活動期〉-
潰瘍性大腸炎(成人)
軽症〜中等症の活動期潰瘍性大腸炎に対する第Ⅱ相用量設定試験1)
| 目的 | 軽症~中等症の活動期潰瘍性大腸炎患者を対象としたペンタサ®錠の有効性、安全性ならびにその至適用量の検討 |
|---|---|
| 対象 |
軽症〜中等症の活動期潰瘍性大腸炎60例 (有効性評価対象:47例、安全性評価対象:54例) |
| 方法 | ペンタサ®錠750mg、1,500mgおよび2,250mgを1日3回に分けて、4週間経口投与した。 |
| 評価項目 |
|
| 解析計画 | 臨床症状改善度、内視鏡所見改善度、全般改善度は、Kruskal-Wallis検定により比較を行った。なお2群間の比較は順位によるTurkey-Kramerの多重比較検討を用いた。副作用発現例及び臨床検査値異常変動例については一覧表を作成し、その頻度を集計した。 |
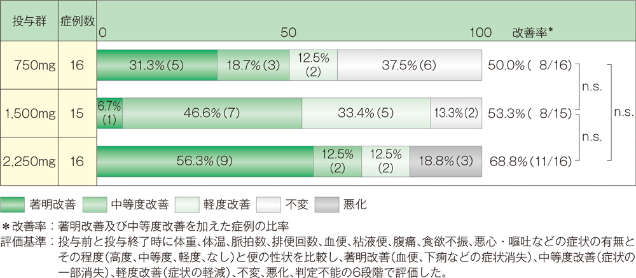
1. 臨床症状改善度
中等度以上の改善率は、750mg投与群では50.0%(8/16例)、1,500mg投与群では53.3%(8/15例)、2,250mg投与群では68.8%(11/16例)でした。なお3群間に有意差は認められませんでした(Kruskal-Wallis検定)。
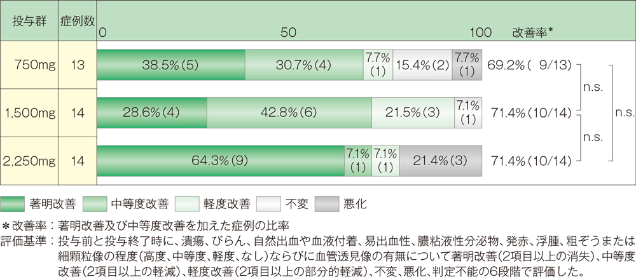
2. 内視鏡所見改善度
中等度以上の改善率は、750mg投与群では69.2%(9/13例)、1,500mg投与群では71.4%(10/14例)、2,250mg投与群では71.4%(10/14例)でした。なお3群間に有意差は認められませんでした(Kruskal-Wallis検定)。
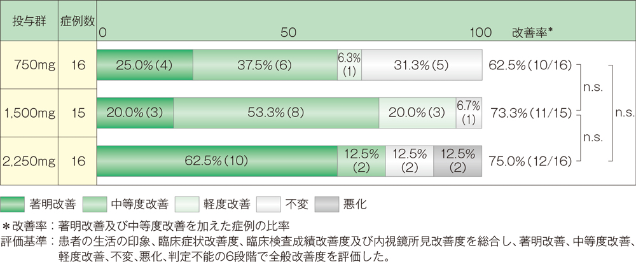
3. 全般改善度
中等度以上の改善率は、750mg投与群では62.5%(10/16例)、1,500mg投与群では73.3%(12/16例)、2,250mg投与群では75.0%(12/16例)でした。なお3群間に有意差は認められませんでした(Kruskal-Wallis検定)。
4. 安全性
副作用は、750mg投与群では腎機能検査異常、便秘、腹痛が各1件認められ、発現率は15.8%(3/19例)でした。2,250mg投与群では肝機能検査異常、下痢、悪心・嘔吐、腹痛、顔面丘疹、胃痛、口内炎が各1件認められ、発現率は26.3%(5/19例)でした。750mg投与群の腹痛と2,250mg投与群の下痢、胃痛、口内炎は中等度で、その他は軽度であり、いずれの症状も投与中止後(投与終了後)または投与継続中に消失しました。投与中止に至った副作用は、750mg投与群では腹痛、便秘が各1件、2,250mg投与群では悪心・嘔吐、下痢が各1件認められました。重篤な副作用及び死亡例は認められませんでした。
臨床検査値異常変動発現率は、750mg投与群では15.8%(3/19例)、1,500mg投与群では6.3%(1/16例)、2,250mg投与群は15.8%(3/19例)でした。薬剤との因果関係が「多分関連あり」の異常変動は、750mg投与群の「尿NAG上昇」、「尿蛋白陽性化」の2件、「関連ないともいえない」の異常変動は、2,250mg投与群の「AST(GOT)上昇」1件であり、これらの異常変動は投与終了後に正常値に回復しました。
6. 用法及び用量(一部抜粋)
通常、成人にはメサラジンとして1日1,500mgを3回に分けて食後経口投与するが、寛解期には、必要に応じて1日1回の投与とすることができる。なお、年齢、症状により適宜増減するが、1日2,250mgを上限とする。
ただし、活動期には、必要に応じて1日4,000mgを2回に分けて投与することができる。
通常、小児にはメサラジンとして1日30~60mg/kgを3回に分けて食後経口投与する。なお、年齢、症状により適宜増減するが、1日2,250mgを上限とする。
7. 用法及び用量に関連する注意
- 7.1 1日4,000mgへの増量は、再燃寛解型で中等症の潰瘍性大腸炎患者(直腸炎型を除く)に対して行うよう考慮すること。
- 7.2 1日4,000mgを、8週間を超えて投与した際の有効性は確立していないため、患者の病態を十分観察し、漫然と1日4,000mgの投与を継続しないこと。
活動期潰瘍性大腸炎に対する用量反応性試験(探索試験)2)、3):1日2,250mg(分3)投与と4,000mg(分2)投与の比較
| 目的 | 活動期潰瘍性大腸炎患者を対象としたペンタサ®2,250mg/日投与とペンタサ®4,000mg/日投与の有効性および安全性についての用量反応性を比較検討 |
|---|---|
| 対象 |
15歳以上65歳未満の初回発作型又は再燃寛解型で、UC-DAIスコア4〜8の活動期潰瘍性大腸炎患者86例(直腸炎型は除く) (有効性評価対象:82例、安全性評価対象:86例) |
| 方法 | ペンタサ®錠1日2,250mg(分3)又は1日4,000mg(分2;ただし投与回数は1日3回で1回はプラセボ投与)を8週間投与 |
| 評価項目 |
|
| 解析計画 | 各投与群における投与前後のスコアの変化量、スコアの変化量の群間差については95%信頼区間を算出し、95%信頼区間が0を含まない場合を有意差ありと判定した。副作用発現例についてはその頻度を集計し、95%信頼区間を算出した。 |
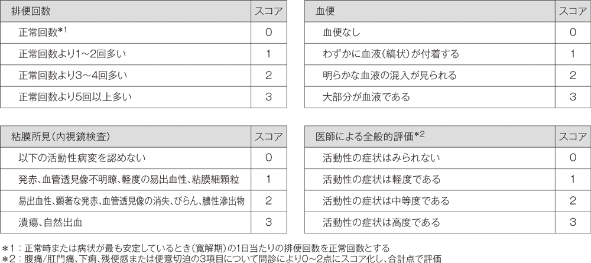
- *UC-DAIスコア:
-
Ulcerative Colitis−Disease Activity Index スコア
「排便回数」、「血便」、「粘膜所見(内視鏡検査)」及び「医師による全般的評価」の4つの評価項目の合計スコアをUC-DAIスコアとする。
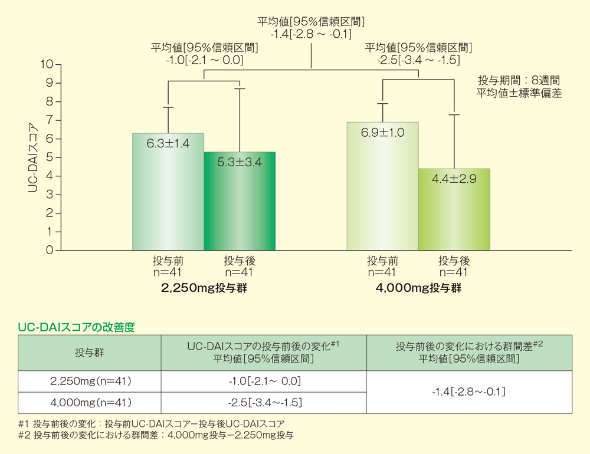
1. 主要評価項目:UC-DAIスコアの改善度
UC-DAIスコアの投与前後の改善度において、1日4,000mg投与の1日2,250mg投与に対する有意差が認められました(群間差[95%信頼区間]=-1.4[-2.8~-0.1])。
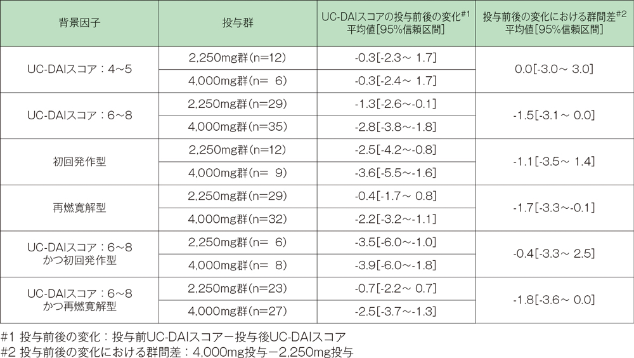
2. 患者背景別UC-DAIスコア改善度
患者背景別UC-DAIスコアを検討した結果、4,000mg投与群が2,250mg投与群より高い有効性を示す患者集団は「再燃寛解型かつUC-DAIスコアが6~8」と考えられました。
3. 安全性3)
有害事象は、2,250mg投与群では77.3%(34/44例)、4,000mg投与群では76.2%(32/42例)に認められました。主な有害事象は、2,250mg投与群では発熱13件、頭痛9件、CRP増加8件、鼻咽頭炎7件、咽喉頭疼痛7件、悪心6件、血中アミラーゼ増加5件、血中鉄減少5件、咳嗽5件などでした。また4,000mg投与群では鼻咽頭炎8件、頭痛8件、発熱5件などでした。
副作用は、2,250mg投与群では27.3%(12/44例)、4,000mg投与群では21.4%(9/42例)に認められました。主な副作用は、2,250mg投与群では血中アミラーゼ増加5件、頭痛4件、発熱2件、CRP増加2件などであり、4,000mg投与群では尿中NAG増加3件などでした。
重篤な副作用は、2,250mg投与群では2例5件に発現し、1例は発熱、CRP増加、他の1例は血中アミラーゼ増加、CRP増加、急性膵炎が認められました。4,000mg投与群では認められませんでした。死亡例は両群とも認められませんでした。
6. 用法及び用量(一部抜粋)
通常、成人にはメサラジンとして1日1,500mgを3回に分けて食後経口投与するが、寛解期には、必要に応じて1日1回の投与とすることができる。なお、年齢、症状により適宜増減するが、1日2,250mgを上限とする。
ただし、活動期には、必要に応じて1日4,000mgを2回に分けて投与することができる。
通常、小児にはメサラジンとして1日30~60mg/kgを3回に分けて食後経口投与する。なお、年齢、症状により適宜増減するが、1日2,250mgを上限とする。
7. 用法及び用量に関連する注意
- 7.1 1日4,000mgへの増量は、再燃寛解型で中等症の潰瘍性大腸炎患者(直腸炎型を除く)に対して行うよう考慮すること。
- 7.2 1日4,000mgを、8週間を超えて投与した際の有効性は確立していないため、患者の病態を十分観察し、漫然と1日4,000mgの投与を継続しないこと。
活動期潰瘍性大腸炎に対する第Ⅲ相用量比較試験(検証試験)2)、3):再燃寛解型で中等症の活動期潰瘍性大腸炎症例を対象とした1日2,250mg(分3)投与と4,000mg(分2)投与の比較
| 目的 | 活動期潰瘍性大腸炎患者を対象としたペンタサ®4,000mg/日投与の2,250mg/日投与に対する優越性の検証、および安全性の比較検討 |
|---|---|
| 対象 |
15歳以上65歳未満の再燃寛解型で、UC-DAIスコア6〜8(中等症)の活動期潰瘍性大腸炎患者123例(直腸炎型は除く) (有効性評価対象:118例、安全性評価対象:123例) |
| 方法 | ペンタサ®錠1日2,250mg(分3)又は1日4,000mg(分2;ただし投与回数は1日3回で1回はプラセボ投与)を8週間投与。 |
| 評価項目 |
|
| 解析計画 |
各投与群における投与前後のスコアの変化量は対応のあるt検定、スコアの変化量の群間差はt検定を用いた。 スコアの変化量、スコアの変化量の群間差は95%信頼区間を算出し比較した。 また寛解率及び有効率は95%信頼区間を算出するとともにWilcoxon順位和検定を用いて両群間を比較した。 副作用発現例についてはその頻度を集計し、95%信頼区間を算出した。 |
- *UC-DAIスコア:
-
Ulcerative Colitis−Disease Activity Index スコア
「排便回数」、「血便」、「粘膜所見(内視鏡検査)」及び「医師による全般的評価」の4つの評価項目の合計スコアをUC-DAIスコアとする。
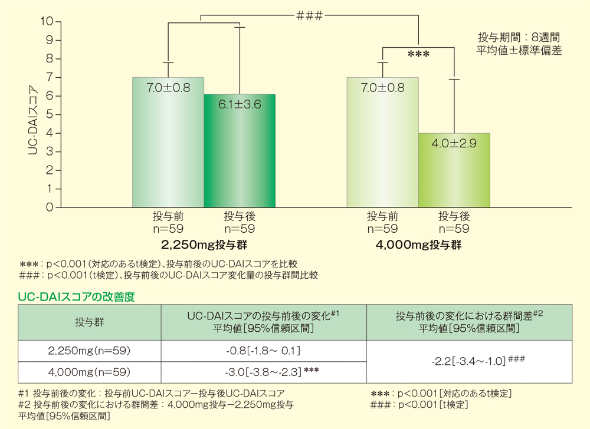
1. 主要評価項目:UC-DAIスコアの改善度
UC-DAIスコアの投与前後の改善度において、1日4,000mg投与の1日2,250mg投与に対する優越性が検証されました(p<0.001、t検定)。
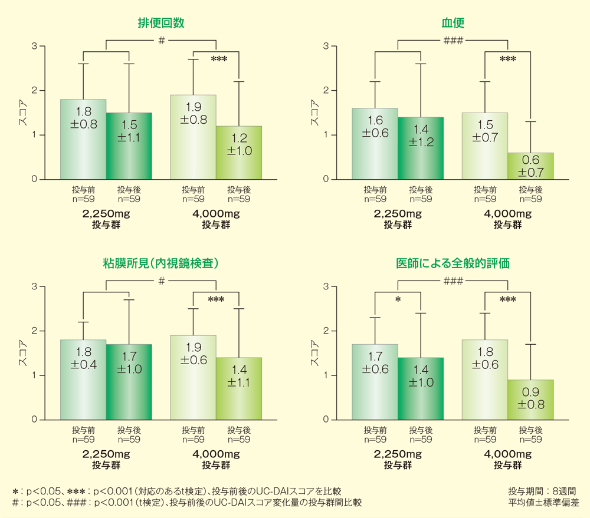
2. 副次評価項目
1)UC-DAIスコア各評価項目の変化
2,250mg投与群は、医師による全般的評価のみが投与前後で有意に低下したのに対し(p<0.05、対応のあるt検定)、4,000mg投与群では排便回数、血便、粘膜所見、医師による全般的評価のいずれも投与前後で有意に低下しました(p<0.001、対応のあるt検定)。また、各評価項目スコアの変化量の群間差もすべて有意差が認められました(排便回数・粘膜所見:p<0.05、血便・医師による全般的評価:p<0.001、いずれもt検定)。
2)寛解率及び有効率
寛解率は4,000mg投与群で高いものの、両群間で有意な差は認められませんでした。一方、有効率は4,000mg投与群で有意に高いことが示されました(p<0.001、Wilcoxon順位和検定)。
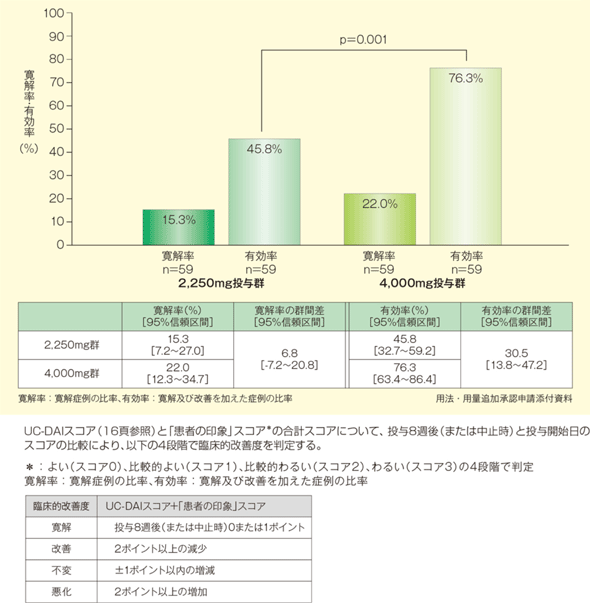
3. 安全性3)
有害事象は、2,250mg投与群では82.5%(52/63例)、4,000mg投与群では76.7%(46/60例)に認められました。主な有害事象は、2,250mg投与群では鼻咽頭炎21件、CRP増加9件、頭痛7件、リンパ球減少3件などでした。また4,000mg群では鼻咽頭炎19件、尿中NAG増加10件、頭痛7件、CRP増加5件、リンパ球減少5件などでした。
副作用は、2,250mg投与群では25.4%(16/63例)、4,000mg投与群では21.7%(13/60例)に認められました。主な副作用は、2,250mg投与群では尿中NAG増加4件、血小板数増加3件、好酸球増加3件などであり、4,000mg投与群では尿中NAG増加6件、血中ビリルビン増加3件、リンパ球減少2件などでした。重篤な副作用は、4,000mg投与群で2例2件に発現し、1例は鼻咽頭炎、他の1例は潰瘍性大腸炎の悪化が認められました。死亡例は両群とも認められませんでした。
6. 用法及び用量(一部抜粋)
通常、成人にはメサラジンとして1日1,500mgを3回に分けて食後経口投与するが、寛解期には、必要に応じて1日1回の投与とすることができる。なお、年齢、症状により適宜増減するが、1日2,250mgを上限とする。
ただし、活動期には、必要に応じて1日4,000mgを2回に分けて投与することができる。
通常、小児にはメサラジンとして1日30~60mg/kgを3回に分けて食後経口投与する。なお、年齢、症状により適宜増減するが、1日2,250mgを上限とする。
7. 用法及び用量に関連する注意
- 7.1 1日4,000mgへの増量は、再燃寛解型で中等症の潰瘍性大腸炎患者(直腸炎型を除く)に対して行うよう考慮すること。
- 7.2 1日4,000mgを、8週間を超えて投与した際の有効性は確立していないため、患者の病態を十分観察し、漫然と1日4,000mgの投与を継続しないこと。
-
1)棟方昭博 他:薬理と治療 1994;22(Suppl.10)S2509-S2530
利益相反:本研究は杏林製薬株式会社の資金により行われた。 -
2)Hiwatashi N. et al.:J Gastroenterol 2011;46:46-56
利益相反:本研究は杏林製薬株式会社の資金により行われた。 - 3)ペンタサ錠の活動期潰瘍性大腸炎に対する用量比較試験(検証試験:社内資料)
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

