-臨床成績 クローン病・SASP不耐性・小児-
クローン病(成人)
活動期クローン病に対する第Ⅱ相用量設定試験1)
| 目的 | 活動期の成人クローン病を対象としたペンタサ®錠の有効性と安全性ならびにその至適用量の検討 |
|---|---|
| 対象 |
軽症〜中等症の活動期クローン病46例 (有効性評価対象:34例、安全性評価対象:42例) |
| 方法 | ペンタサ®錠1日1,500mgまたは3,000mg投与の2群に無作為に割付し、1日3回に分けて4週間以上12週間経口投与した。 |
| 評価項目 |
|
| 解析計画 | 臨床症状改善度、形態学的改善度、全般有効度については2標本Wilcoxon検定を用いた。副作用発現例及び臨床検査値異常変動例については一覧表を作成し、その頻度を集計した。 |
1. 臨床症状改善度
「中等度改善」以上の改善率は、投与4週後では1,500mg投与群で21.1%(4/19例)、3,000mg投与群では46.7%(7/15例)であり、投与12週あるいは投与終了時では1,500mg投与群で41.2%(7/17例)、3,000mg投与群で42.9%(6/14例)でした。なお投与4週後、12週後において2群間に有意差は認められませんでした(2標本Wilcoxon検定)。
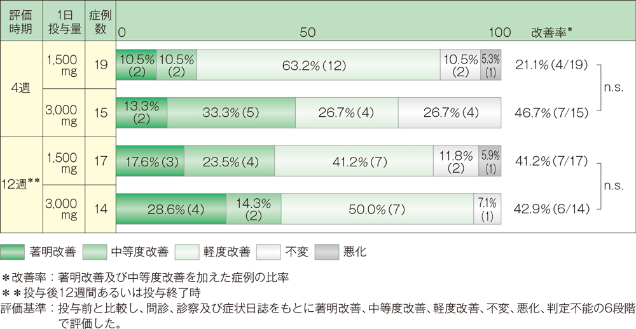
2.形態学的改善度
「中等度改善」以上の改善は、投与4週後では1,500mg投与群で4例中2例、3,000mg投与群では5例中1例であり、投与12週あるいは投与終了時では1,500mg投与群で8例中4例、3,000mg投与群で6例中4例でした。なお投与4週後、12週後において2群間に有意差は認められませんでした(2標本Wilcoxon検定)。
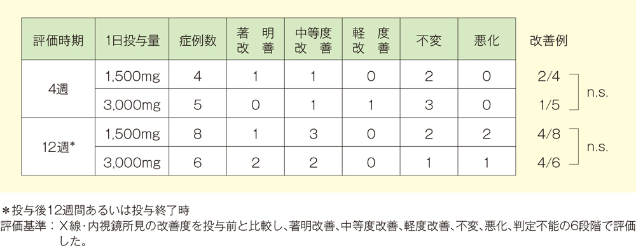
3. 全般改善度
「中等度改善」以上の改善率は、投与4週後では1,500mg投与群で26.3%(5/19例)、3,000mg投与群では53.3%(8/15例)であり、投与12週あるいは投与終了時では1,500mg投与群で52.9%(9/17例)、3,000mg投与群で57.1%(8/14例)でした。なお投与4週後、12週後において2群間に有意差は認められませんでした(2標本Wilcoxon検定)。
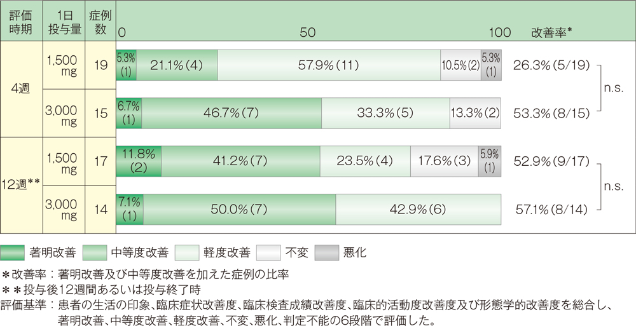
4. 安全性
副作用発現率は、1,500mg投与群では0%(0/22例)、3,000mg投与群では10.0%(2/20例)であり、その内訳は胃部不快感の1例1件と悪心・腹痛の1例2件でした。投与中止に至った副作用は、3,000mg投与群の2例であり、重篤な副作用及び死亡例は認められませんでした。
臨床検査値異常変動のうち、薬剤との因果関係が「多分関連あり」の異常変動は、3,000mg投与群のAST(GOT)上昇、ALT(GPT)上昇の2件、「関連ないともいえない」の異常変動は、1,500mg投与群の尿NAG、AST(GOT)上昇、ALT(GPT)上昇の3件であった。
6. 用法及び用量(一部抜粋)
通常、成人にはメサラジンとして1日1,500mg~3,000mgを3回に分けて食後経口投与する。なお、年齢、症状により適宜減量する。
通常、小児にはメサラジンとして1日40~60mg/kgを3回に分けて食後経口投与する。なお、年齢、症状により適宜増減する。
寛解期クローン病に対する長期投与試験2)
| 目的 | 寛解期クローン病を対象としたペンタサ®錠の長期間使用での寛解維持効果と安全性についての検討 |
|---|---|
| 対象 |
寛解期のクローン病14例 (有効性評価対象:10例 安全性評価対象:10例) |
| 方法 | ペンタサ®錠1,500mg〜3,000mgを1日3回に分けて12ヵ月間投与経口投与した。 |
| 評価項目 |
|
| 解析計画 | 臨床症状、形態学的寛解維持効果、全般有効度について集計を行った。発現例及び臨床検査値異常変動例については一覧表を作成し、その頻度を集計した。 |
1. 安全性
副作用(臨床症状)は認められませんでした。臨床検査値異常変動の発現率は10.0%(1/10例)であり、その内訳は、尿NAG上昇が1例でした。
2.臨床症状
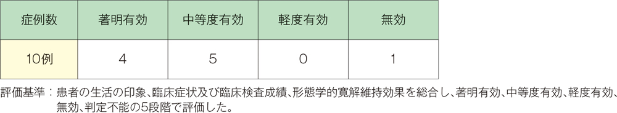
臨床症状が「中等度有効」以上は、10例中9例でした。
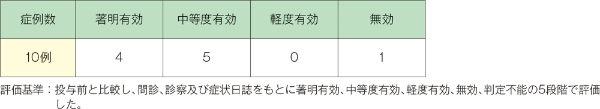
3.形態学的寛解維持効果
形態学的寛解維持効果が判定可能であった症例において、「中等度有効」以上は1例中1例でした。

4.全般有効度
寛解期症例10例に対して「中等度有効」以上の症例は9例でした。
6. 用法及び用量(一部抜粋)
〈クローン病〉
通常、成人にはメサラジンとして1日1,500mg~3,000mgを3回に分けて食後経口投与する。なお、年齢、症状により適宜減量する。
通常、小児にはメサラジンとして1日40~60mg/kgを3回に分けて食後経口投与する。なお、年齢、症状により適宜増減する。
潰瘍性大腸炎(SASP不耐性)
サラゾスルファピリジン(SASP)不耐性症例※に対する臨床効果3)
- ※ SASP不耐性症例: サラゾスルファピリジン不耐性症例とは薬剤過敏症状、肝機能障害などの発現のため、サラゾスルファピリジン継続投与に耐えられない症例
| 目的 | 軽症~中等症の活動期ならびに寛解期の潰瘍性大腸炎におけるSASP不耐性患者を対象としたペンタサ®錠の有効性の検討 |
|---|---|
| 対象 |
軽症ならびに中等症の活動期もしくは寛解期のSASP不耐性の潰瘍性大腸炎23例 ・活動期評価対象:17例 ・寛解期評価対象:8例(治験期間中に活動期から寛解期に移行した5例含む) |
| 方法 | ペンタサ®錠750mg〜2,250mgを1日3回に分けて2週間以上6ヵ月以内で経口投与した。 |
| 評価項目 |
|
| 解析計画 | 各評価項目について集計を行った。副作用発現例及び臨床検査値異常変動例については一覧表を作成し、その頻度を集計した。 |
1.活動期症例
①臨床症状改善度
活動期における「中等度改善」以上の改善率*は50.0%(8/16例)でした。

②内視鏡所見改善度
活動期における「中等度改善」以上の改善率*は80.0%(8/10例)でした。

③全般改善度
活動期における「中等度改善」以上の改善率*は75.0%(12/16例)でした。

2.寛解期症例
①臨床症状
寛解期における「中等度有効」以上の改善率*は8例中8例でした。

②内視鏡所見
再燃が疑われた2症例で実施された内視鏡検査の結果、再燃は1例でした。

③全般有効度
寛解期における「中等度有効」以上の改善率*は8例中8例でした。

3.安全性
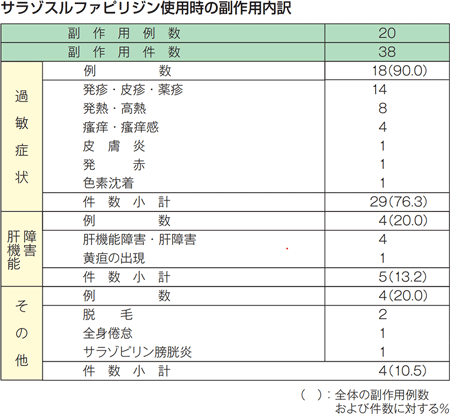
副作用発現率は、10.0%(2/20例)でした。内訳は1,500mg/日投与36日目で軽度の胸部発疹のみられた1例、及び1,500mg/日投与1回で中等度の全身倦怠、皮疹、発熱の3件がみられた1例でした。投与中止に至った副作用は、前述の2例であり、重篤な副作用及び死亡例は認められませんでした。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 サラゾスルファピリジンに対する過敏症のある患者
本剤をサラゾスルファピリジンでアレルギー症状がみられた患者に投与したところ、国内の臨床試験で39例中3例(7.7%)、外国において43例中2例(4.7%)に同様のアレルギー症状が認められた。そのため、サラゾスルファピリジンでアレルギー症状がみられた患者に本剤を投与する場合は注意すること。
潰瘍性大腸炎・クローン病(小児)
ペンタサ®錠は、小児に対して新たな臨床試験を実施しておらず、承認の際、審査・評価された特定使用成績調査の成績を紹介します。
特定使用成績調査成績4)
| 目的 | 小児を対象としたペンタサ®錠の製造販売後の使用実態下における安全性及び有効性の検討 |
|---|---|
| 対象 |
過去2年間に1度でもペンタサ®錠250mgが投与され、かつ、投与時年齢が15歳未満の潰瘍性大腸炎及びクローン病小児例134例 ※有効性評価対象症例:潰瘍性大腸炎89例、クローン病37例、計126例 ※安全性評価対象症例:潰瘍性大腸炎97例、クローン病37例、計134例 |
| 方法 | レトロスペクティブ調査 |
| 評価項目 |
〈活動期症例〉
全般改善度(著明改善、改善、やや改善、不変、悪化により評価) 等 〈寛解期症例〉 寛解維持率(有効率) |
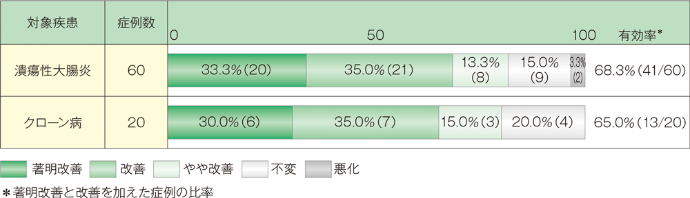
1. 活動期潰瘍性大腸炎及びクローン病に対する全般改善度
2.寛解期潰瘍性大腸炎及びクローン病に対する寛解維持率(有効率)

3. 安全性
副作用は、潰瘍性大腸炎症例では4例(4.5%)7件に発現し、その内訳は、嘔吐、血便、血中アミラーゼ値増加、血中リパーゼ値増加、白血球数減少、好中球数減少、間質性腎炎が各1件認められました。クローン病症例では報告されませんでした。
6. 用法及び用量(一部抜粋)
〈潰瘍性大腸炎〉
通常、小児にはメサラジンとして1日30~60mg/kgを3回に分けて食後経口投与する。なお、年齢、症状により適宜増減するが、1日2,250mgを上限とする。
〈クローン病〉
通常、小児にはメサラジンとして1日40~60mg/kgを3回に分けて食後経口投与する。なお、年齢、症状により適宜増減する。
9. 特定の背景を有する患者に関する注意
-
9.7 小児等
専門医の管理下で安全性と治療の有益性を考慮した上で本剤を使用すること。小児等を対象とした臨床試験は実施していない。
-
1)棟方昭博 他:薬理と治療 1994;22(Suppl.10)S2531-S2554
利益相反:本研究は杏林製薬株式会社の資金により行われた。 -
2)棟方昭博 他:薬理と治療 1994;22(Suppl.10)S2625-S2638
利益相反:本研究は杏林製薬株式会社の資金により行われた。 -
3)棟方昭博 他:薬理と治療 1994;22(Suppl.10)S2585-S2605
利益相反:本研究は杏林製薬株式会社の資金により行われた。 -
4)豊田 茂 他:日本小児栄養消化器肝臓学会雑誌 2009;23:16-23
利益相反:本研究は杏林製薬株式会社の資金により行われた。
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

