-製剤学的特徴・薬物動態-
製剤学的特徴
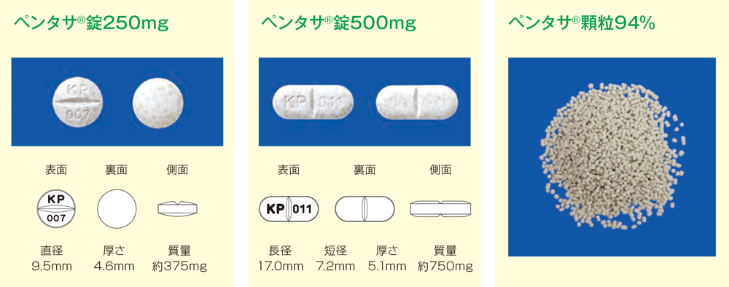
ペンタサ®は、メサラジンを有効成分とする製剤です。
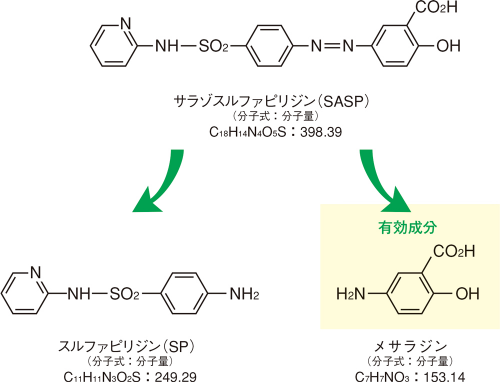
潰瘍性大腸炎の治療薬として用いられるサラゾスルファピリジンは、メサラジンとスルファピリジン(SP)がアゾ結合した化学構造を有し、大腸の腸内細菌により、メサラジンとSPに分解されます。
炎症性腸疾患に対する活性部位はメサラジンであることが既に報告されています1)。
ペンタサ®経口剤は小腸から大腸の全域にわたってメサラジンを放出するよう製剤設計した放出調節製剤(controlled-release formulation)です。
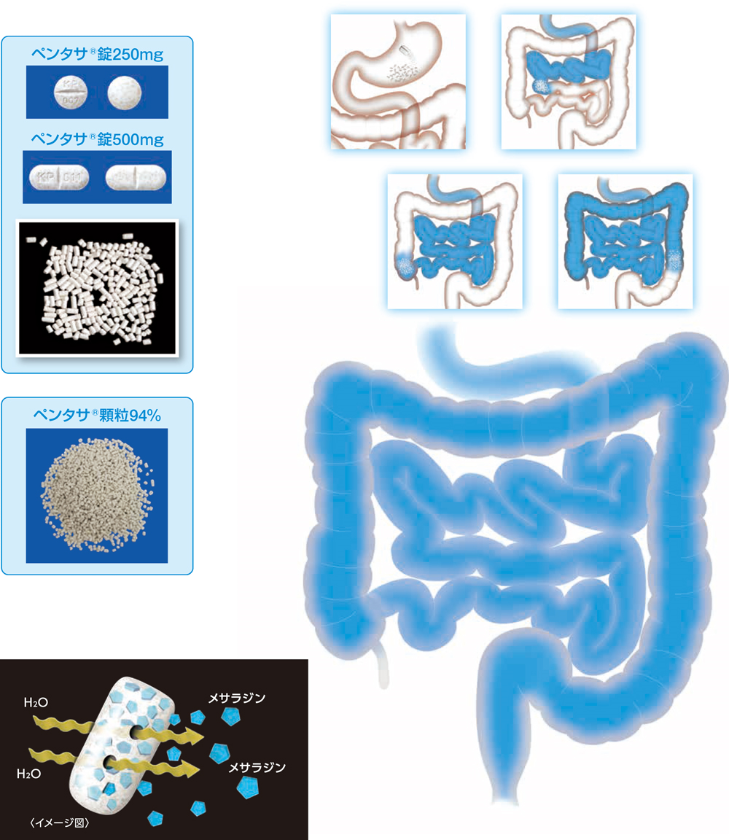
メサラジン原薬をそのまま経口投与すると、病変部位に到達する前に小腸上部で吸収されます。ペンタサ®経口剤は、メサラジンを1mm前後の顆粒(錠剤表面にみえる灰白色の斑点)にし、エチルセルロースの多孔性被膜でコーティングすることにより、メサラジンの消化管内での放出を調節するよう工夫された製剤です。
その結果、消化管上部から下部末端まで安定したメサラジンの持続放出能を示しました2)。
14. 適用上の注意
《ペンタサ®錠250mg、ペンタサ®錠500mg》
- 14.1 薬剤交付時の注意
- PTP包装の薬剤はPTPシートから取り出して服用するよう患者に指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
- 14.2 薬剤投与時の注意
- 本剤は二分割して服用可能であるが、放出調節製剤であることより、かまずに服用すること。また、乳鉢による混合粉砕は避けること。
《ペンタサ®顆粒94%》
- 14.1 薬剤投与時の注意
- 本剤は放出調節製剤であることより、かまずに服用すること。また、乳鉢による混合粉砕は避けること。
薬物動態
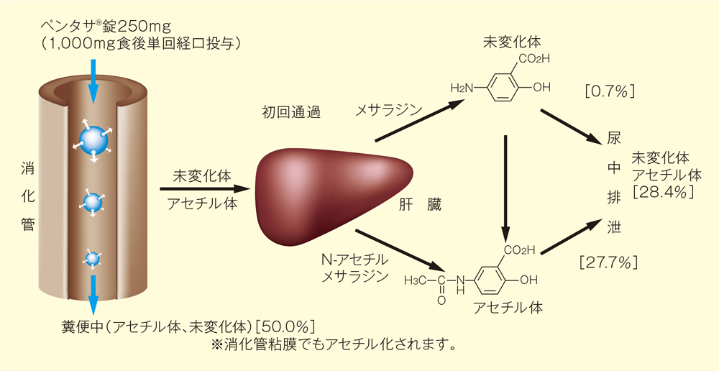
メサラジンの放出は直腸末端まで続き、一部吸収されたものはアセチル化を受け、尿中に排泄されます2)。
吸収
1)単回投与試験(健康成人男子)3)
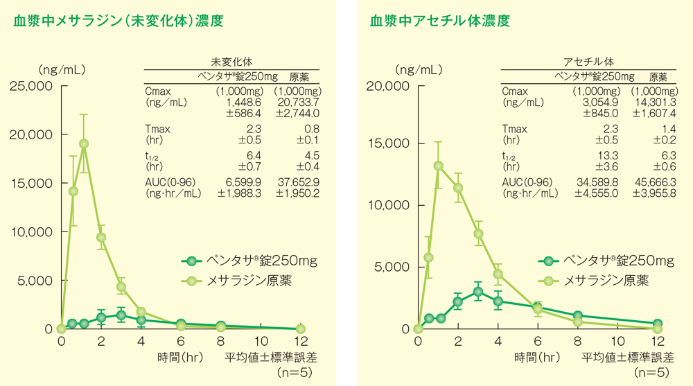
ペンタサ®錠250mg(メサラジンとして1,000mg)またはメサラジン原薬(メサラジンとして1,000mg)を各群5例に単回経口投与(空腹時)し、比較した結果、ペンタサ®錠250mgの吸収量はメサラジン原薬に比べ低く、放出調節による吸収の抑制が認められました。
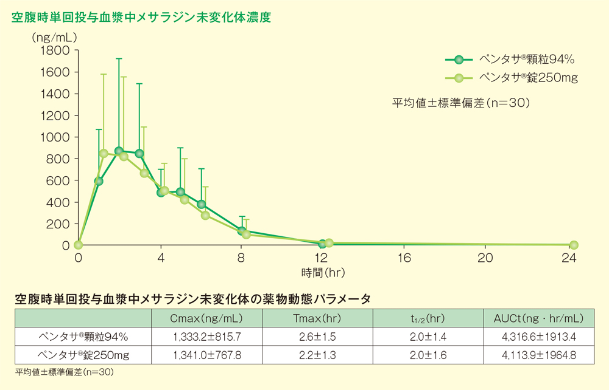
2)ペンタサ®顆粒94%及びペンタサ®錠250mgの単回経口投与4)
ペンタサ®顆粒94%又はペンタサ®錠250mg(両剤共メサラジンとして1,000mg)を空腹時に単回経口投与した同等性試験において、両剤は生物学的に同等であることが確認されました。
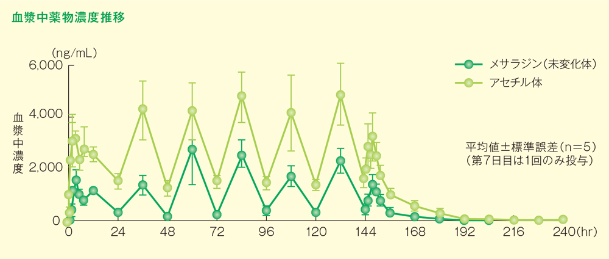
3)反復投与試験(健康成人男子)
ペンタサ®錠250mg 4錠(メサラジンとして1,000mg)を5例に1日3回、7日間反復経口投与したとき、血漿中のメサラジン未変化体及びアセチル体濃度はともに4日間以内に定常状態に達し、体内蓄積性は認められませんでした。
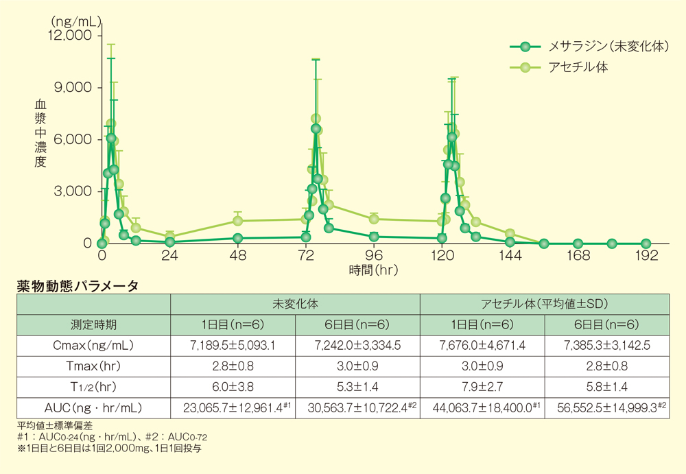
ペンタサ®錠250mg 8錠(メサラジンとして2,000mg)を6例に1日2回、6日間反復経口投与したとき、血漿中のメサラジン未変化体及びアセチル体濃度はともに4日間以内に定常状態に達し、体内蓄積性は認められませんでした。
分布
1)組織内濃度(ラット)6)
- 方法:
- 14Cで標識したメサラジンをラットに50mg/kgを単回経口投与し、経時的に組織内放射能濃度を測定しました。(n=3)
- 結果:
- 投与後30分で最高濃度を示し、胃、小腸上部、腎臓、膀胱などの吸収・排泄臓器に血漿よりも高い分布を示しました。しかし、他臓器への移行は少なく、血液-脳関門は通過せず、胎盤通過性も低い値を示しました。
- 方法:
- 14Cで標識したメサラジンをラットに50mg/kgを1日1回14日間反復経口投与し、初回、6回、10回及び14回各投与後24時間における組織内放射能濃度を測定しました。(n=3)
- 結果:
- 14日間反復投与によって各組織で投与回数に伴う濃度上昇が認められましたが、最終投与後120時間に各組織内の濃度は最高濃度の3%以下でした。
2)蛋白結合率(in vitro)7)
- 方法:
- 限外濾過法により、メサラジンとアセチル体の血漿蛋白に対する結合率をヒト血漿を用いて測定しました。(n=3)
- 結果:
- メサラジン及びアセチル体濃度0.1〜10μg/mLにおける血漿蛋白結合率は、それぞれ、69.7〜70.1%、85.1〜86.6%でした。
代謝(ラット)8)
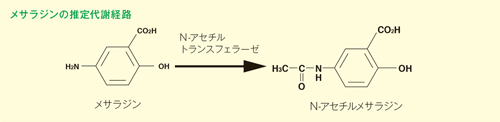
ラットにおいて、メサラジンは全身に分布するN-アセチルトランスフェラーゼ(NAT)によって生体内で安定なアセチル体(N-アセチルメサラジン)に代謝され、経口投与の場合は消化管、肝臓が主な代謝部位になっています。なお、アセチル体には薬理作用は認められませんでした。
排泄
1)単回経口投与(健康成人男子)3)
ペンタサ®錠250mg 1錠〜5錠(メサラジンとして250〜1,250mg)を健康成人25例に単回経口投与した結果、投与後96時間までのメサラジンの尿中への排泄は投与量に対して約20〜30%であり、そのほとんどがアセチル体として排泄されました。一方、糞中への排泄は投与量に対して約50〜60%でした。
2)反復投与(健康成人男子)9)
ペンタサ®錠250mg 8錠(メサラジンとして2,000mg)を健康成人6例に1日2回、6日間反復経口投与した結果、尿中排泄は投与開始後4日間以内に定常状態に達し、体内蓄積性は認められず、144時間後までの累積尿中排泄率は34.7%(アセチル体として25.6%)でした。
- 1)Azad Khan A. K. et al.:Lancet 1977;2:892-895
- 2)檜垣晴夫 他:薬理と治療 1994;22(Suppl.10):S2467-S2495
- 3)豊田 茂 他:日本小児栄養消化器肝臓学会雑誌 2009;23:16-23
- 4)ペンタサ顆粒94%の体内動態(社内資料:承認時評価資料)
- 5)檜垣晴夫 他:薬理と治療 1994;22(Suppl.10):S2497-S2507
- 6)田中友希夫 他:医薬品研究 1994;25(8):704-718
- 7)承認申請添付資料
- 8)田中友希夫 他:薬理と治療 1994; 22(8):3501
- 9)国内第Ⅰ相反復投与試験(用法・用量追加時:社内資料)
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

