-安全性-
安全性薬理試験1)
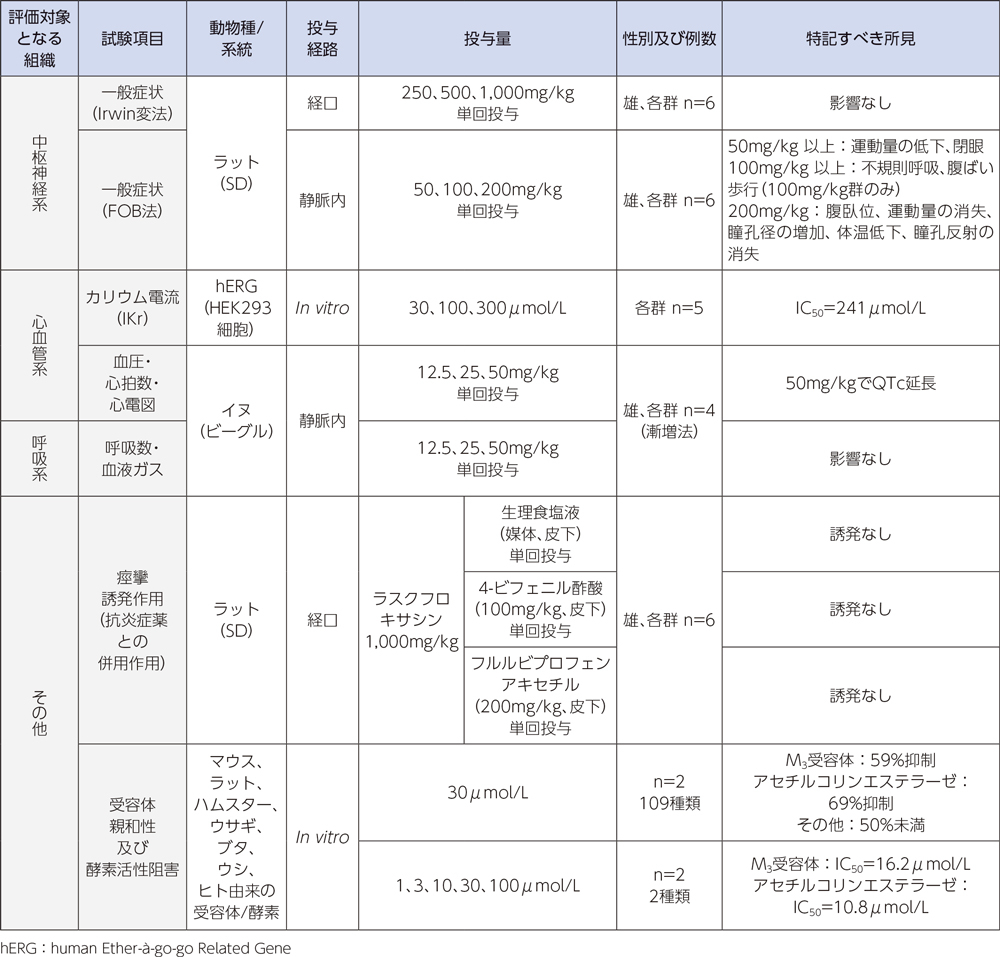
毒性試験2)
(1)単回投与毒性試験

(2)反復投与毒性試験
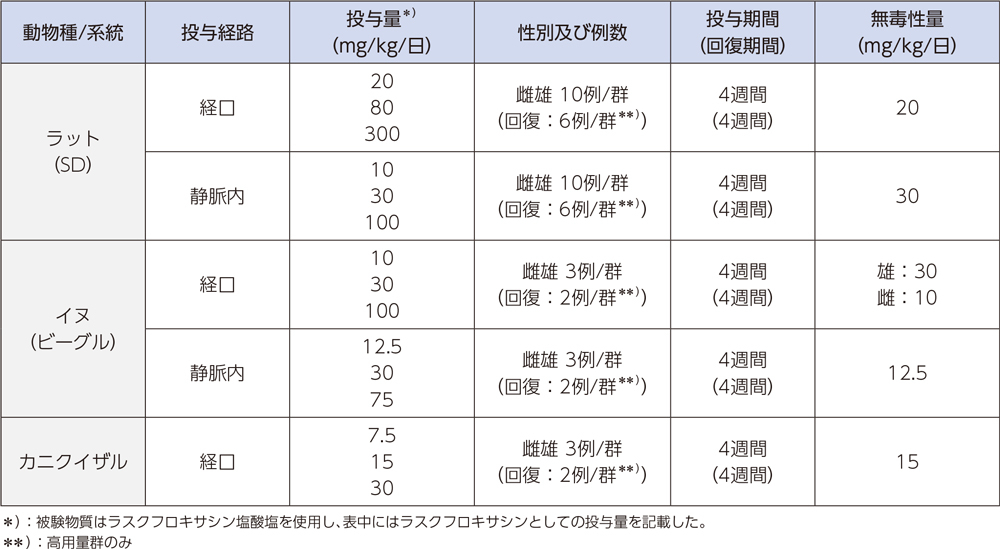
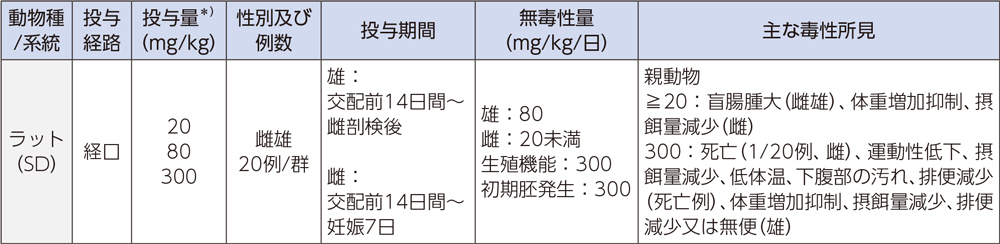
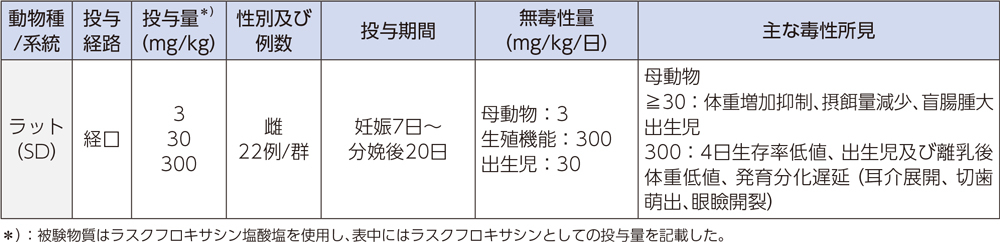
(3)生殖発生毒性試験
1)受胎能及び着床までの初期胚発生に関する試験
2)胚・胎児発生に関する試験
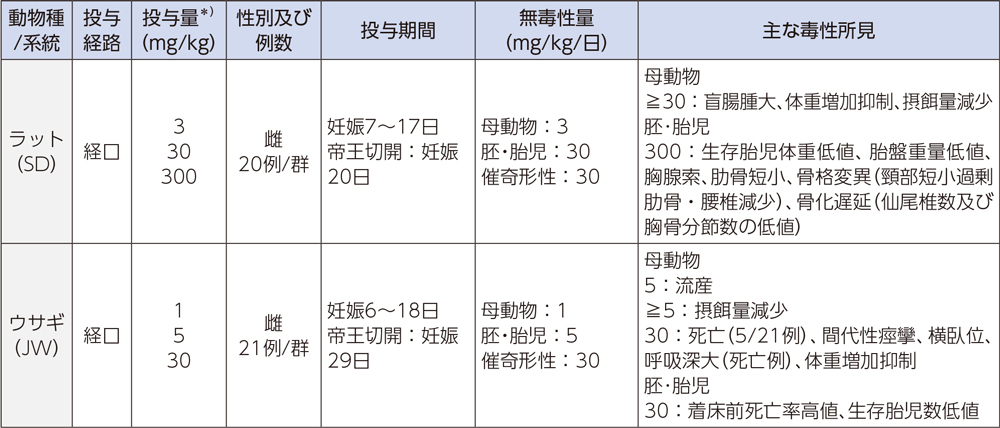
3)出生前及び出生後の発生並びに母体の機能に関する試験
(4)その他の特殊毒性試験
1)遺伝毒性試験
ラスクフロキサシンのin vitro試験では、細菌を用いる復帰突然変異試験は陰性、ほ乳類培養細胞を用いる染色体異常試験及びマウスリンフォーマTk試験はいずれも陽性であった。一方、ラットを用いたin vivo試験では、小核試験、不定期DNA合成試験及び遺伝子突然変異試験、いずれも陰性であった。ラットに小核誘発作用が認められなかった。
2)がん原性試験
雌雄rasH2マウスにラスクフロキサシンを26週間反復経口投与し、がん原性を評価した。雌雄ともにいずれの組織・器官に対してもがん原性が認められなかった。
3)光毒性試験
雄有色ラット(Long-Evans)にラスクフロキサシン100及び1,000mg/kgを単回経口投与後、投与3時間後より長波長紫外線(UVA)約10J/cm2を120分間照射。照射0.5、24、48及び72時間後に耳介及び背部皮膚の観察。照射72時間後に眼科的検査及び眼球の病理組織学的検査を実施した結果、耳介及び背部の皮膚反応、耳介厚、眼科的検査及び眼球の病理組織学的検査に異常はなく、光毒性反応は認められなかった。
4)関節毒性試験
ラスクフロキサシンは、ラット*1及びサル*2の反復投与毒性試験で関節への影響は認められなかったが、若齢イヌ(投与開始時6ヵ月齢)*3の2週間及び4週間反復投与毒性試験で、大腿骨又は上腕骨の関節軟骨にブリスターや関節腔の滑液増加が観察された。成熟イヌ(投与開始16ヵ月齢:雄ビーグル)*4にラスクフロキサシン30、75mg/kgを2週間反復静脈内投与して関節への影響を検討したが、各関節に異常は観察されず、成熟イヌにおける関節に対する無毒性量は75mg/kgと判断した。
*1:経口及び静脈内投与、*2:経口投与、*3:経口及び静脈内投与、*4:静脈内投与
5)局所刺激性試験
ラスクフロキサシンのウサギの単回筋肉内投与試験では、0.2w/v%及びその2倍濃度である0.4w/v%で試験し、「注射剤の局所障害性に関する試験法(案)」3)における分類に従い評価したところ、局所障害性はそれぞれグレード2注1)及びグレード3注2)に分類された。
- 注1:
- 投与2日後及び14日後のいずれの判定結果も0.425w/v%酢酸と比べて、その局所障害性が弱いが、いずれかの判定結果が生理食塩水と比べ、その局所障害性が強い。
- 注2:
- 投与2日後及び14日後のいずれの判定結果も1.7w/v%酢酸と比べて、その局所障害性が弱いが、いずれかの判定結果が0.425w/v%酢酸と比べ、その局所障害性が同等又は強い。
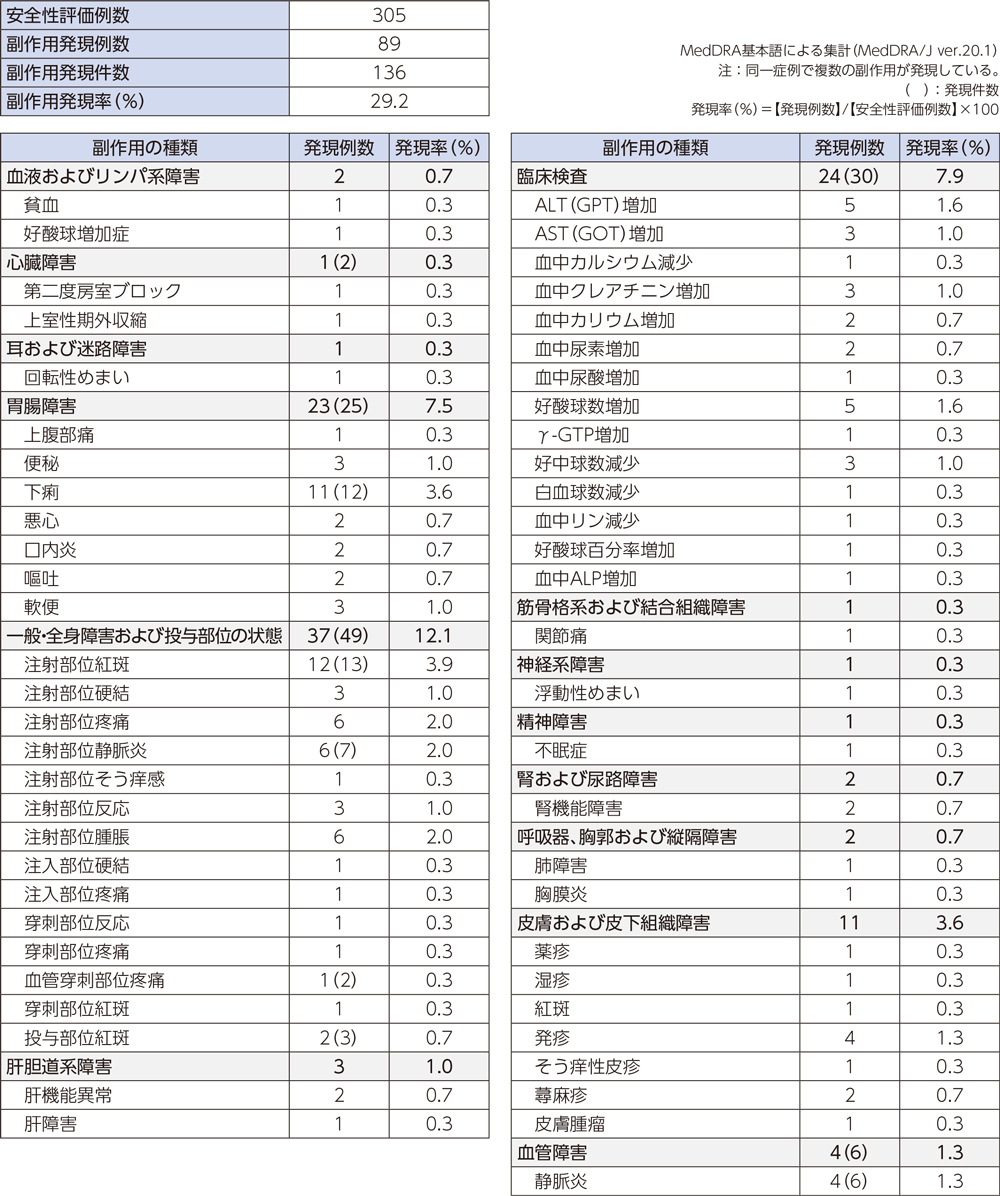
副作用
国内で実施された臨床試験において、305例中89例(29.2%)に副作用が認められた。主な副作用は、注射部位紅斑12例3.9%、下痢11例3.6%、注射部位疼痛、注射部位静脈炎、注射部位腫脹各6例2.0%であった。(承認時)
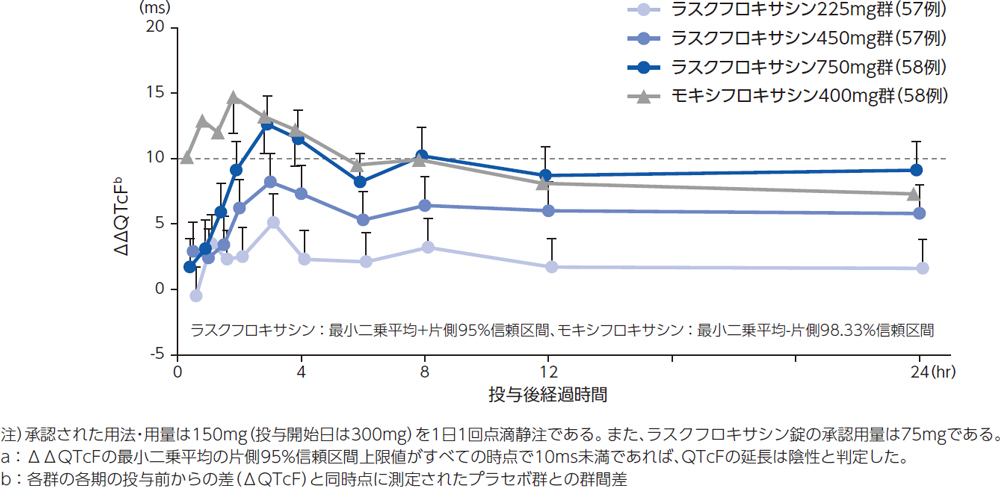
QT/QTc間隔延長に対する作用4)[経口投与試験]
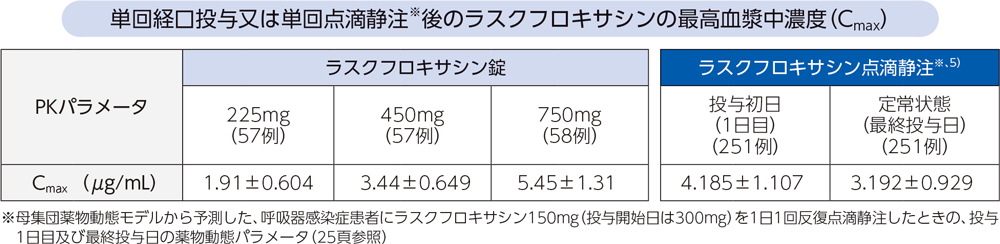
健康成人のべ172例を対象とした無作為化二重盲検クロスオーバー試験において、ラスクフロキサシン225mg注)(57例)、450mg注)(57例)及び750mg注)(58例)単回経口投与時のQT/QTc延長をQTcF(Fridericia法による心拍数補正QT)を用いて評価した結果、225mg投与群が陰性、450mg投与群以上で陽性と判定されたa。なお、健康成人に450mg経口投与時のCmax(3.44±0.649μg/mL)は、呼吸器感染症患者に本剤の用法・用量投与時のCmax(投与初日4.185±1.107μg/mL、定常状態3.192±0.929μg/mL)5)と同程度である。
- 2
- 禁忌(次の患者には投与しないこと)〈抜粋〉
- 2.2
- QT延長のある患者(先天性QT延長症候群等)[8.3、9.1.2、11.1.4参照]
- 2.3
- 低カリウム血症のある患者[9.1.2、11.1.4参照]
- 2.4
- クラスⅠA(キニジン、プロカインアミド等)又はクラスⅢ(アミオダロン、ソタロール等)の抗不整脈薬を投与中の患者[10.1参照]
- 2.5
- 重度の肝機能障害のある患者[9.3.1参照]
- 8.
- 重要な基本的注意〈抜粋〉
- 8.3
- 本剤投与によりQT間隔が延長するおそれがあるため、本剤の投与開始前及び投与中は患者の状態を十分に観察し、必要に応じて心電図検査等を実施すること。[2.2、9.1.2、11.1.4参照]
- 9.
- 特定の背景を有する患者に関する注意〈抜粋〉
- 9.1
- 合併症・既往歴等のある患者
- 9.1.2
- 重度の徐脈等の不整脈、虚血性心疾患、心不全等の心疾患のある患者
心室頻拍(Torsade de pointesを含む)、QT延長を起こすおそれがある。[2.2、2.3、8.3、11.1.4参照]
- 9.3
- 肝機能障害患者
- 9.3.1
- 重度の肝機能障害のある患者
投与しないこと。血漿中濃度上昇のおそれがある。[2.5参照]
- 10.
- 相互作用〈抜粋〉
- 10.1
- 併用禁忌(併用しないこと)
クラスⅠA抗不整脈薬 キニジン、プロカインアミド等 クラスⅢ抗不整脈薬 アミオダロン、ソタロール等[2.4参照]
- 11.
- 副作用〈抜粋〉
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
- 11.1
- 重大な副作用
- 11.1.4
- QT延長、心室頻拍(Torsade de pointesを含む)(いずれも頻度不明)[2.2、2.3、8.3、9.1.2参照]
- 1)承認時評価資料:ラスクフロキサシンの安全性薬理試験.
- 2)承認時評価資料:ラスクフロキサシンの毒性試験.
- 3)厚生労働省, 注射剤の局所障害性に関する試験法(案).医薬ジャーナル. 15(3): 447-449(1979)
- 4)承認時評価資料:ラスクフロキサシン(錠)の臨床薬理試験.
- 5)承認時評価資料:ラスクフロキサシン(点滴静注)の臨床薬理試験.
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

