-臨床成績 疾患別評価-
市中肺炎を対象とした第Ⅱ相試験(用量設定試験)1)
| 目的 |
市中肺炎患者に対するラスクフロキサシン75mg及び150mg点滴静脈内投与(投与開始日は倍量投与)の有効性、安全性などを検討する。 |
|---|---|
| 対象 |
20歳以上80歳未満の軽症から重症の市中肺炎患者84例 |
| 試験デザイン |
無作為化非盲検並行群間比較試験 |
| 方法 |
ラスクフロキサシン75mg投与群及びラスクフロキサシン150mg投与群に1:1の比で無作為に割付け、各群の被験者背景を可能な限り均一とするため、年齢及び肺炎の重症度を割付因子として、動的割付を行った。被験者にはラスクフロキサシン75mg(投与開始日は150mg)またはラスクフロキサシン150mg(投与開始日は300mg)を1日1回、約1時間(投与開始日は約2時間を目安)かけて7日間点滴静注した。7日間の投与により改善傾向がみられ、治療上継続投与すべきと治験責任医師等が判断した場合、最長14日間まで投与可能とした。 |
| 評価項目 |
有効性評価項目:
安全性評価項目:有害事象、心電図パラメータ 等 |
| 解析計画 |
治癒率、有効率及び菌消失率を算出し、その両側95%信頼区間を算出した。解析対象は、PPS(治験実施計画書に適合した集団:Per Protocol Set)及びFAS(最大の解析対象集団:Full Analysis Set)とし、有効性の主たる解析対象集団はPPSとした。 |
各評価項目の算出方法
- 治癒率(%)=(各投与群の「治癒」と判定された被験者数÷各投与群の「治癒」又は「治癒せず」と判定された被験者数)×100
- 有効率(%)=(各投与群の「治癒」と判定された被験者数÷各投与群の「治癒」又は「治癒せず」と判定された被験者数)×100
- 菌消失率(%)=(各投与群の「消失」、「推定消失」又は「菌交代症」と判定された被験者数÷各投与群の「消失」、「推定消失」、「菌交代症」、「存続」、「推定存続」、「重複感染」又は「再燃」と判定された被験者数)×100
微生物学的効果の判定基準2)
| 消失 | 適切に採取された検体から、当該抗菌薬の投与後に原因菌が検出されなかった場合。 |
|---|---|
| 推定消失 | 治療によって臨床症状が改善または消失し、当初の感染病巣から検査に適した検体が得られなくなった場合、原因菌は消失したものと推定する。 |
| 菌交代症 | 治療により当初の原因菌は消失し、それ以外の当該抗菌薬に感受性を示さない新たな病原微生物が、明らかな感染症の症状や徴候を伴って同じ部位から検出された場合。 |
| 存続 | 感染病巣から当初の原因菌が検出された場合。 |
| 推定存続 | 臨床症状の改善がみられず、適切に採取された検体からの分離培養が不可能あるいは実施されなかった場合、原因菌は存続していると推定する。 |
| 重複感染 | 当初の原因菌が存続するとともに異なる新たな微生物の出現をみることがある。これに伴って、臨床的あるいは検査上の感染所見が持続もしくは増悪する場合を重複感染とする。 |
| 再燃 | 原因菌の消失が証明されるが、それ以降に再び同じ感染部位の検体から同じ病原菌が検出された場合。 |
| 判定不能 | 種々の理由により微生物学的検査が実施されなかったなど、上述のいずれの判定もできない場合。 |
通常、成人にはラスクフロキサシンとして、投与初日に300mgを、投与2日目以降は150mgを1日1回点滴静注する。
1)投与終了7日後の臨床効果:治癒率(PPS)[主要評価項目]
市中肺炎患者に対する投与終了7日後の臨床効果(治癒率)は、ラスクフロキサシン75mg群で90.6%、150mg群で94.4%であった。
![投与終了7日後の臨床効果:治癒率(PPS)[主要評価項目]](/product/lsint/images/14-01.jpg)
2)投与終了時の臨床効果:有効率(PPS)[副次評価項目]
投与終了時の臨床効果(有効率)は、ラスクフロキサシン75mg群で97.0%、150mg群で97.4%であった。
![投与終了時の臨床効果:有効率(PPS)[副次評価項目]](/product/lsint/images/14-02.jpg)
3)投与終了7日後の被験者別微生物学的効果:菌消失率(BPPS)[副次評価項目]
投与終了7日後の被験者別微生物学的効果(菌消失率)は、ラスクフロキサシン75mg群で100%、150mg群で93.8%であった。
![投与終了7日後の被験者別微生物学的効果:菌消失率(BPPS)[副次評価項目]](/product/lsint/images/14-03.jpg)
4)安全性
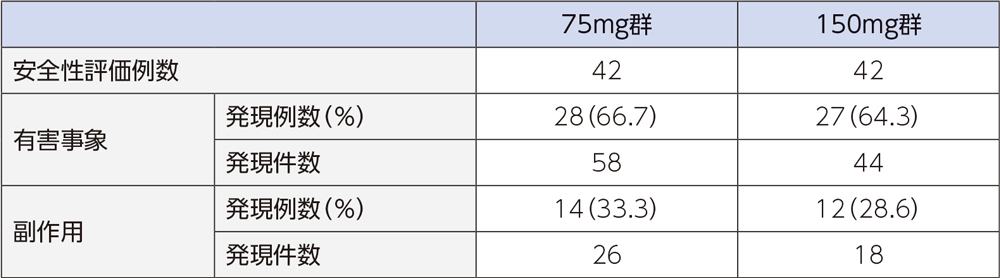
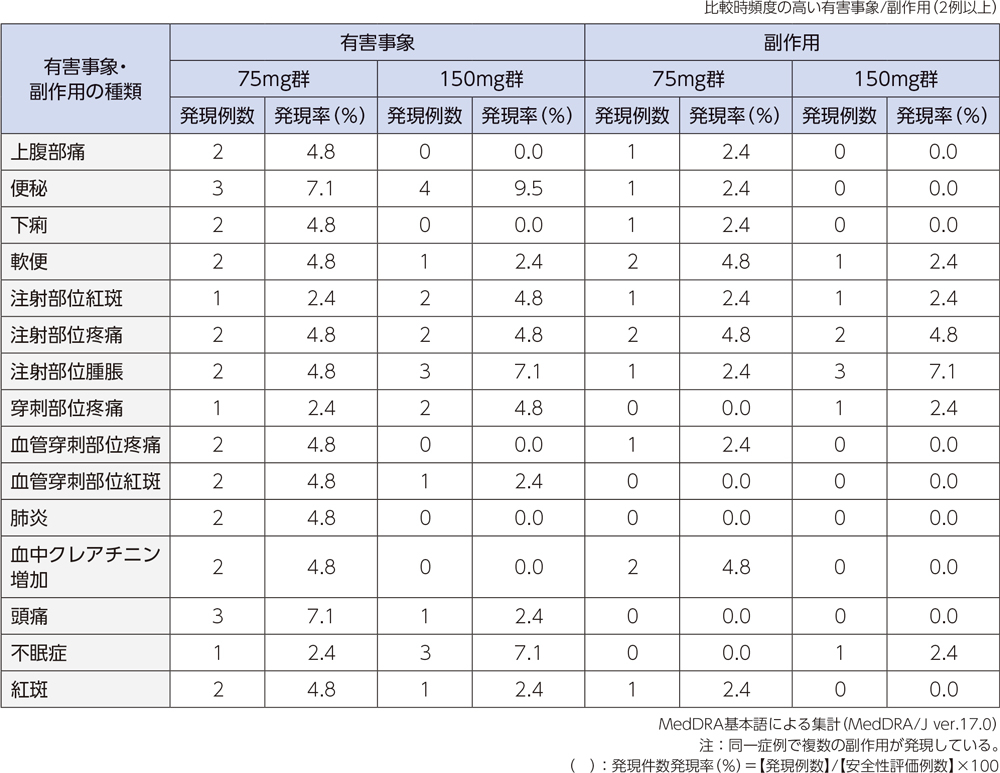
投与中止に至った有害事象は、75mg群では各1例(第7脳神経麻痺、肝障害)、150mg群では各1例(好中球数減少、蕁麻疹)であった。重篤な有害事象は、75mg群では肺炎の2例2件、第7脳神経麻痺、慢性心不全、出血性脳梗塞、心膜炎各1例1件、150mg群では肛門膿瘍の1例1件であった。
投与中止に至った副作用は、75mg群では肝障害の1例1件であった。150mg群では好中球数減少、蕁麻疹の各1例1件であった。重篤な副作用は、認められなかった。
市中肺炎患者を対象とした国内第Ⅲ相二重盲検比較試験3)
| 目的 |
市中肺炎患者を対象として、レボフロキサシン500mg1日1回点滴静注に対するラスビック®点滴静注キット150mg1日1回点滴静注(投与開始日は倍量投与)の治癒率の非劣性を検証する。あわせて安全性の検討も行う。 |
|---|---|
| 対象 |
16歳以上79歳以下の市中肺炎患者286例(治験薬投与症例) |
| 試験デザイン |
無作為化二重盲検並行群間比較試験 |
| 方法 |
ラスビック®点滴静注キット150mg群またはレボフロキサシン500mg群に1:1に無作為に割付け、各群の被験者背景を可能な限り均一とするため、年齢及び体重を調整因子とする動的割付を行った。被験者にはラスビック®点滴静注キット150mg(投与開始日は300mg)またはレボフロキサシン500mgを1日1回、約1時間(投与開始日は約2時間)かけて7日間点滴静注した。7日間の投与により改善傾向がみられ、治療上継続投与すべきと治験責任医師等が判断した場合、最長14日間まで投与可能とした。 |
| 評価項目 |
有効性評価項目:
安全性評価項目:有害事象、心電図パラメータ 等 |
| 解析計画 |
解析対象は、PPS(治験実施計画書に適合した集団:Per Protocol Set)及びFAS(最大の解析対象集団:Full Analysis Set)とし、有効性の主たる解析対象集団はPPSとした。 |
各評価項目の算出方法
- 治癒率(%)=(各投与群の「治癒」と判定された被験者数÷各投与群の「治癒」又は「治癒せず」と判定された被験者数)×100
- 有効率(%)=(各投与群の「有効」と判定された被験者数÷各投与群の「有効」又は「無効」と判定された被験者数)×100
- 菌消失率(%)=(各投与群の「消失」又は「推定消失」と判定された被験者数÷各投与群の「消失」、「推定消失」、「存続」又は「推定存続」と判定された被験者数)×100
微生物学的効果の判定基準2)
| 消失 | 適切に採取された検体から、当該抗菌薬の投与後に原因菌が検出されなかった場合。 |
|---|---|
| 推定消失 | 治療によって臨床症状が改善または消失し、当初の感染病巣から検査に適した検体が得られなくなった場合、原因菌は消失したものと推定する。 |
| 存続 | 感染病巣から当初の原因菌が検出された場合。 |
| 推定存続 | 臨床症状の改善がみられず、適切に採取された検体からの分離培養が不可能あるいは実施されなかった場合、原因菌は存続していると推定する。 |
| 判定不能 | 種々の理由により微生物学的検査が実施されなかったなど、上述のいずれの判定もできない場合。 |
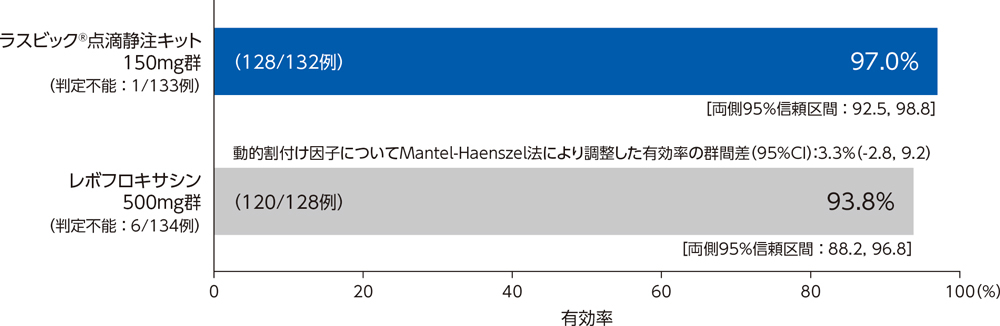
1)投与終了7日後の臨床効果:治癒率(PPS)[主要評価項目]
市中肺炎患者に対する投与終了7日後の臨床効果(治癒率)は、ラスビック®点滴静注キット150mg群で95.2%、レボフロキサシン500mg群で90.0%であり、群間差の95%信頼区間の下限が-10%を下回らなかったことから、ラスビック®点滴静注キット150mg群のレボフロキサシン500mg群に対する非劣性が検証された。
![投与終了7日後の臨床効果:治癒率(PPS)[主要評価項目]](/product/lsint/images/17-01.jpg)
2)投与終了時の臨床効果:有効率(PPS)[副次評価項目]
投与終了時の臨床効果(有効率)は、ラスビック®点滴静注キット150mg群で97.0%、レボフロキサシン500mg群で93.8%であった。
3)投与終了7日後の被験者別微生物学的効果:菌消失率(BPPS)[副次評価項目]
投与終了7日後の被験者別微生物学的効果(菌消失率)は、ラスビック®点滴静注キット150mg群で97.6%、レボフロキサシン500mg群で91.7%であった。
![投与終了7日後の被験者別微生物学的効果:菌消失率(BPPS)[副次評価項目]](/product/lsint/images/17-03.jpg)
4)安全性
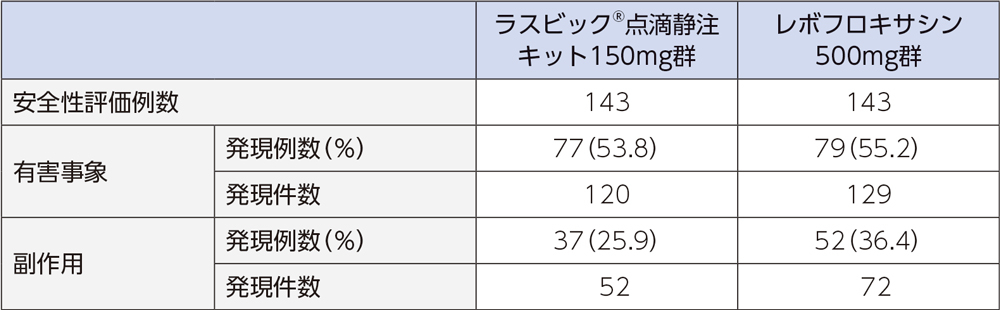
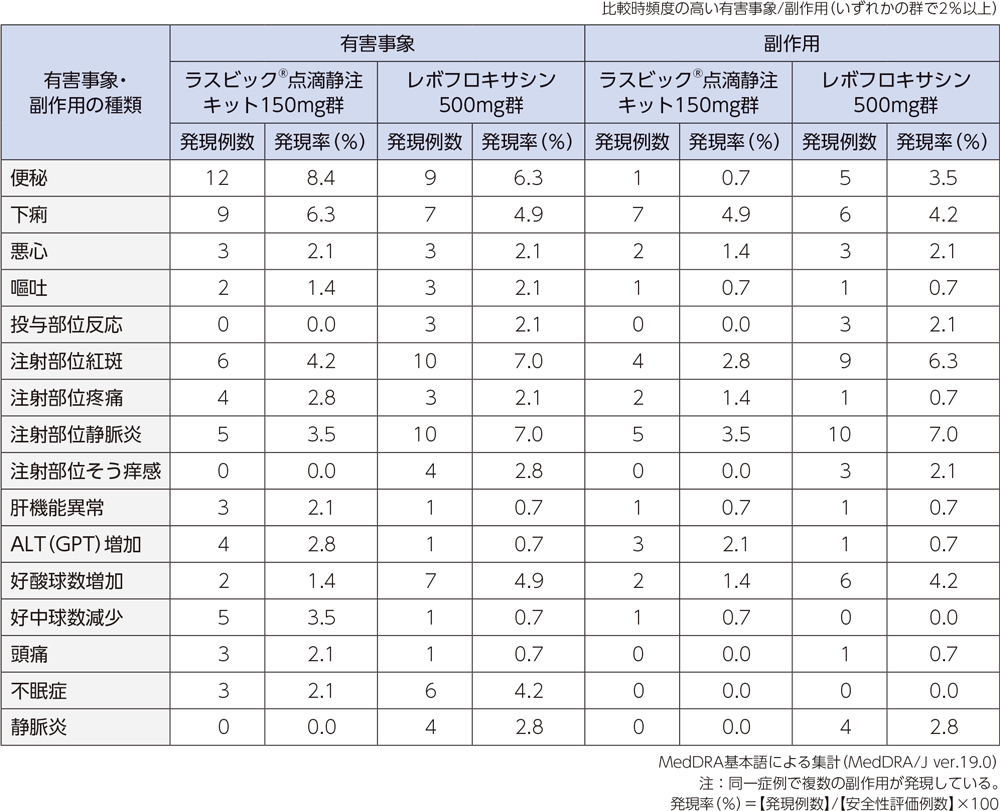
投与中止に至った有害事象は、ラスビック®点滴静注キット150mg群では5例(肝機能異常、そう痒性皮疹、腎機能障害、湿疹、器質化肺炎 各1例1件)、レボフロキサシン500mg群では10例(静脈炎3例3件、紅斑2例2件、注射部位静脈炎、肝機能異常、注射部位紅斑、感染性皮膚嚢腫、器質化肺炎 各1例1件)であった。重篤な有害事象は、ラスビック®点滴静注キット150mg群では2例2件(上気道の炎症、気胸)、レボフロキサシン500mg群では3例3件(誤嚥性肺炎、胆管結石、低ナトリウム血症)であった。
投与中止に至った副作用は、ラスビック®点滴静注キット150mg群では肝機能異常、そう痒性皮疹、腎機能障害、湿疹が各1例1件であった。レボフロキサシン500mg群では静脈炎3例3件、紅斑2例2件、注射部位静脈炎、肝機能異常、注射部位紅斑が各1例1件であった。重篤な副作用は、レボフロキサシン500mg群の低ナトリウム血症1例であった。
呼吸器感染症患者を対象とした国内第Ⅲ相非盲検非対照試験4)
| 目的 |
呼吸器感染症患者を対象として、ラスビック®点滴静注キット150mg 1日1回投与(投与開始日は倍量投与)の有効性、安全性などを検討する。 |
|---|---|
| 対象 |
16歳以上の呼吸器感染症(慢性呼吸器病変の二次感染、誤嚥性肺炎、肺化膿症・肺膿瘍)患者78例 |
| 試験デザイン |
非盲検非対照試験 |
| 方法 |
ラスビック®点滴静注キット150mg(投与開始日は300mg)を1日1回、約1時間(投与開始日は約2時間)かけて点滴静注した。投与期間は7日間(最長14日間)とした。 |
| 評価項目 |
有効性評価項目: 慢性呼吸器病変の二次感染
誤嚥性肺炎、肺化膿症・肺膿瘍
安全性評価項目:安全性評価項目:有害事象、心電図パラメータ 等 |
| 解析計画 |
慢性呼吸器病変の二次感染について、治癒率を算出し、その両側95%信頼区間を算出した。また対象疾患別に、有効率及び菌消失率を算出し、その両側95%信頼区間を算出した。 |
各評価項目の算出方法
- 治癒率(%)=(各投与群の「治癒」と判定された被験者数÷各投与群の「治癒」又は「治癒せず」と判定された被験者数)×100
- 有効率(%)=(各投与群の「有効」と判定された被験者数÷各投与群の「有効」又は「無効」と判定された被験者数)×100
- 菌消失率(%)=(各投与群の「消失」又は「推定消失」と判定された被験者数÷各投与群の「消失」、「推定消失」、「存続」又は「推定存続」と判定された被験者数)×100
微生物学的効果の判定基準2)
| 消失 | 適切に採取された検体から、当該抗菌薬の投与後に原因菌が検出されなかった場合。 |
|---|---|
| 推定消失 | 治療によって臨床症状が改善または消失し、当初の感染病巣から検査に適した検体が得られなくなった場合、原因菌は消失したものと推定する。 |
| 存続 | 感染病巣から当初の原因菌が検出された場合。 |
| 推定存続 | 臨床症状の改善がみられず、適切に採取された検体からの分離培養が不可能あるいは実施されなかった場合、原因菌は存続していると推定する。 |
| 判定不能 | 種々の理由により微生物学的検査が実施されなかったなど、上述のいずれの判定もできない場合。 |
慢性呼吸器病変の二次感染
1)投与終了7日後の臨床効果:治癒率(PPS)[主要評価項目]
慢性呼吸器病変の二次感染における投与終了7日後の臨床効果(治癒率)は、93.3%であった。
![投与終了7日後の臨床効果:治癒率(PPS)[主要評価項目]](/product/lsint/images/20-01.jpg)
2)投与終了時の臨床効果:有効率(PPS)[副次評価項目]
慢性呼吸器病変の二次感染における投与終了時の臨床効果(有効率)は、97.8%であった。
![投与終了時の臨床効果:有効率(PPS)[副次評価項目]](/product/lsint/images/20-02.jpg)
3)投与終了7日後の被験者別微生物学的効果:菌消失率(BPPS)[副次評価項目]
慢性呼吸器病変の二次感染における投与終了7日後の被験者別微生物学的効果(菌消失率)は95.2%であった。
![投与終了7日後の被験者別微生物学的効果:菌消失率(BPPS)[副次評価項目]](/product/lsint/images/20-03.jpg)
誤嚥性肺炎注1)、肺化膿症注2)・肺膿瘍
1)投与終了時の臨床効果:有効率(PPS)[主要評価項目]
投与終了時の臨床効果(有効率)は、誤嚥性肺炎で100%、肺化膿症・肺膿瘍で90.9%であった。
![投与終了時の臨床効果:有効率(PPS)[主要評価項目]](/product/lsint/images/21-01.jpg)
2)投与終了時の被験者別微生物学的効果:菌消失率(BPPS)[副次評価項目]
投与終了時の被験者別微生物学的効果(菌消失率)は、誤嚥性肺炎で91.7%、肺化膿症・肺膿瘍で90.9%であった。
![投与終了時の被験者別微生物学的効果:菌消失率(BPPS)[副次評価項目]](/product/lsint/images/21-02.jpg)
注1)誤嚥性肺炎は誤嚥の関与が疑われる市中肺炎として適応症の肺炎に含まれる
注2)肺化膿症は適応症の肺膿瘍に含まれる
<適応症>
肺炎、肺膿瘍、慢性呼吸器病変の二次感染
安全性

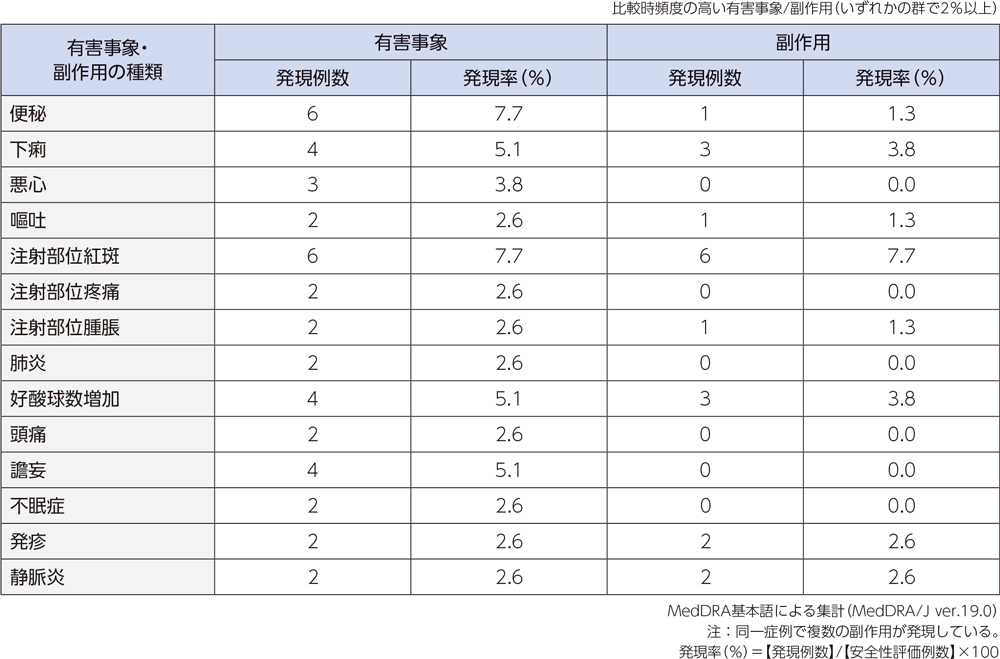
投与中止に至った有害事象は、4例6件(肺炎、肺障害及び薬疹、好中球数減少、血中クレアチニン増加及び貧血)であった。
重篤な有害事象は6例6件に認められ、その内訳は肺炎(2例2件)、アルコール中毒、気胸、肺障害、喘息(各1例1件)であった。
投与中止に至った副作用は、3例5件(肺障害、薬疹、好中球数減少、血中クレアチニン増加及び貧血)であった。
重篤な副作用は、1例1件(肺障害)であった。
- 1)承認時評価資料:市中肺炎を対象とした第Ⅱ相試験(用量設定試験)(AMY-I201)
- 2)日本化学療法学会呼吸器感染症における新規抗微生物薬の臨床評価法見直しのための委員会. 呼吸器感染症における新規抗菌薬の臨床評価法(第二版). 日化療会誌, 60(1): 30-45(2012)
- 3)承認時評価資料:市中肺炎患者を対象とした国内第Ⅲ相二重盲検比較試験(AMY-I301)
- 4)承認時評価資料:呼吸器感染症患者を対象とした国内第Ⅲ相非盲検非対照試験(AMY-I302)
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

