-薬物動態-
血中濃度1、2)
(1)単回投与1)
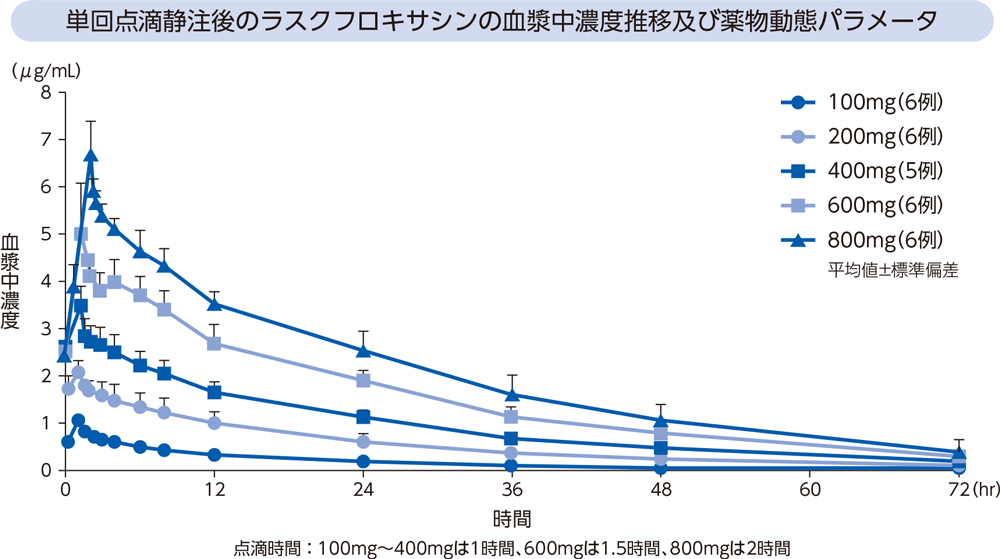
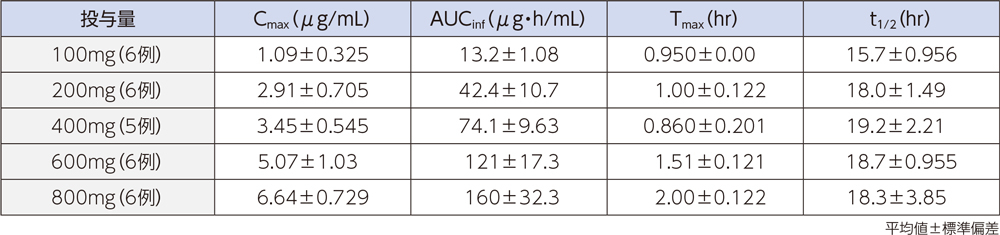
健康成人にラスクフロキサシン100、200、400、600及び800mgを単回点滴静注したときの、血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。
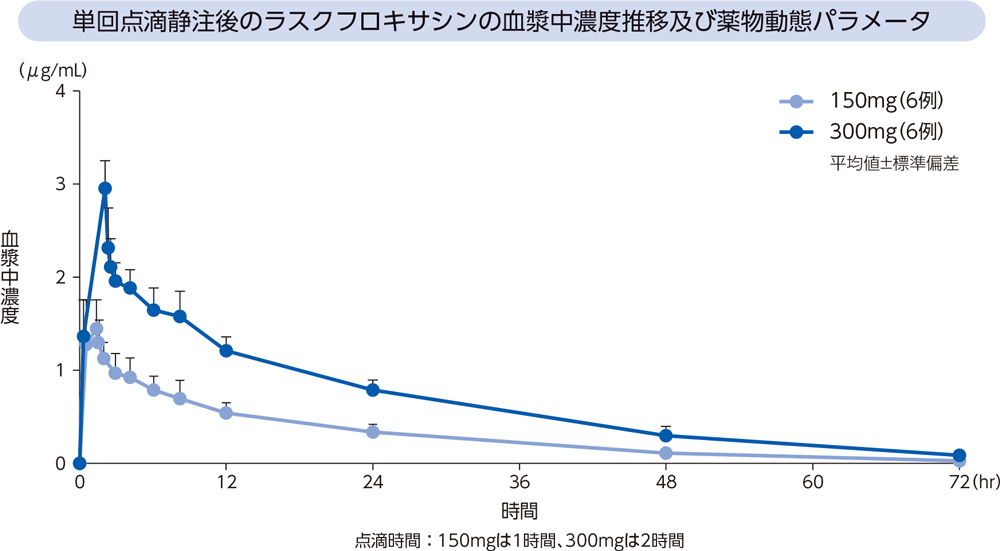
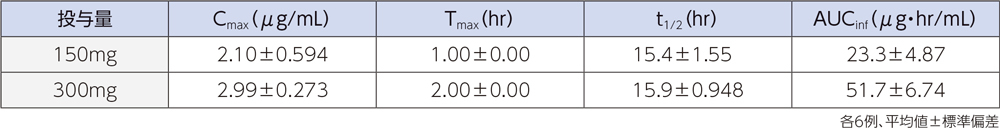
健康成人12例(各投与群6例)にラスクフロキサシン150及び300mgを単回点滴静注したときの、血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。
通常、成人にはラスクフロキサシンとして、投与初日に300mgを、投与2日目以降は150mgを1日1回点滴静注する。
(2)反復投与1)
健康成人6例にラスクフロキサシンを1日目は300mgを2時間かけて、2日目~7日目は150mgを1時間かけて、1日1回7日間反復点滴静注したときの血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。
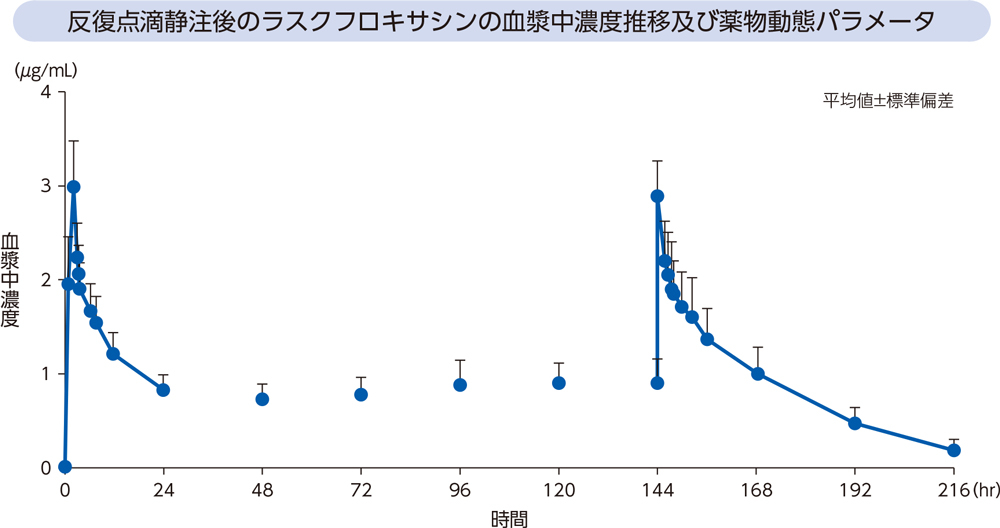
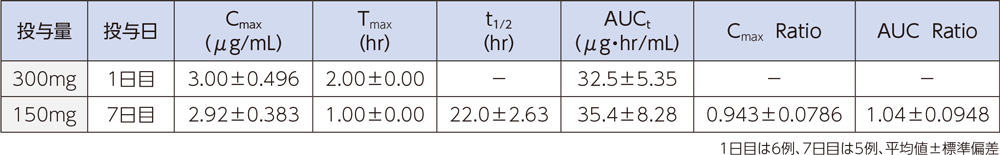
(3)感染症患者1)
母集団薬物動態モデルから予測した、呼吸器感染症患者にラスクフロキサシン150mg(投与開始日は300mg)を1日1回反復点滴静注したときの、投与1日目及び最終投与日の薬物動態パラメータは以下のとおりであった。
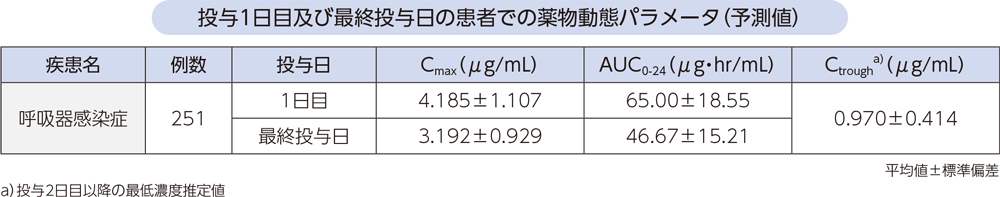
(4)点滴静注と経口投与の比較1、2)
健康成人各6例にラスクフロキサシン150mgを1時間で単回点滴静注又は単回経口投与したときの薬物動態パラメータは、以下のとおりであった。AUClastから算出した150mg経口投与のバイオアベイラビリティは95%であった。
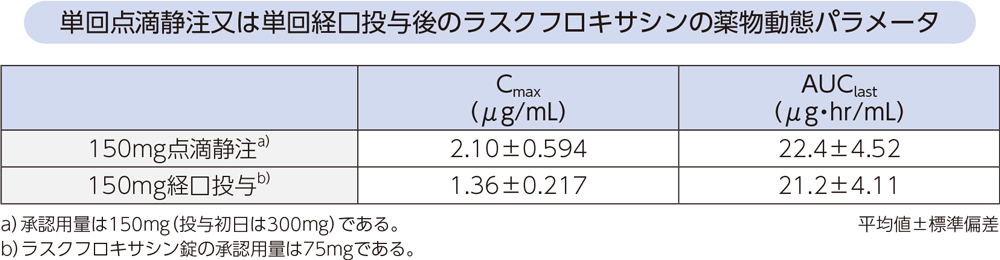
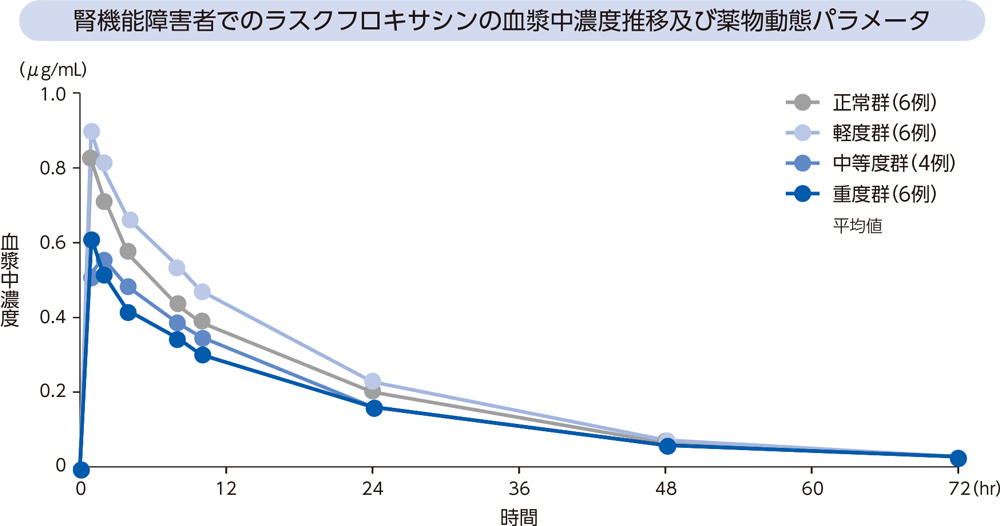
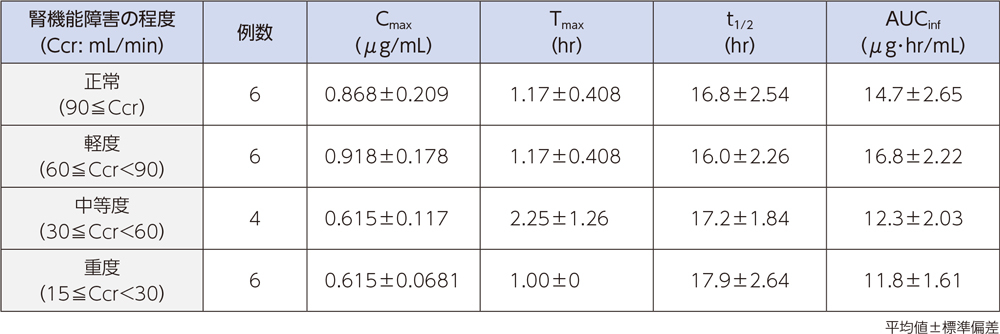
(5)腎機能障害者2)[経口投与試験]
腎機能障害者にラスクフロキサシン75mgを単回経口投与したとき、血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。
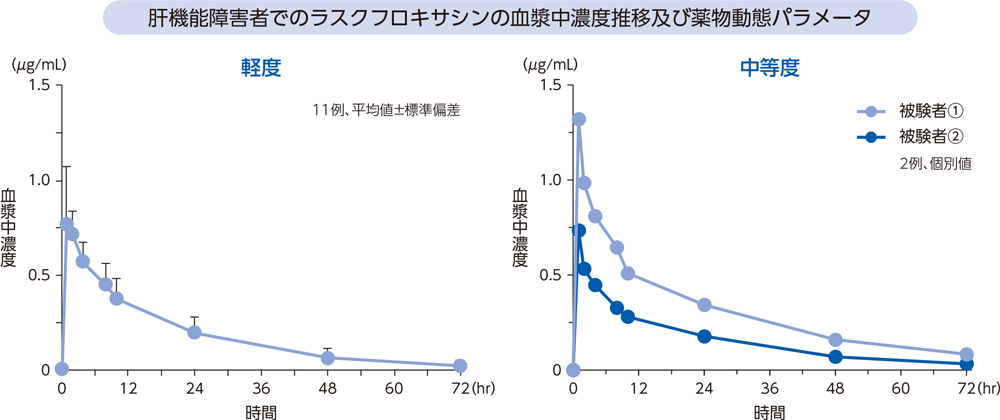
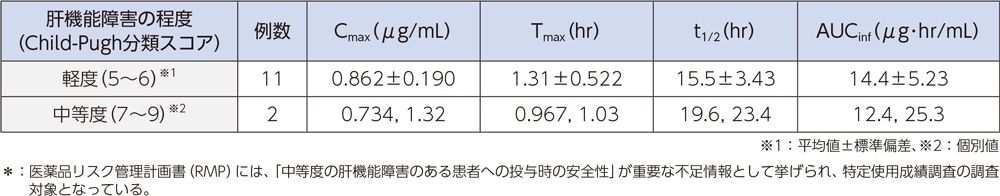
(6)肝機能障害者2)、*[経口投与試験]
肝機能障害が軽度及び中等度の被験者にラスクフロキサシン75mgを単回経口投与したとき、血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。
- 9.
- 特定の背景を有する患者に関する注意〈抜粋〉
- 9.3
- 肝機能障害患者
- 9.3.1
- 重度の肝機能障害のある患者
投与しないこと。血漿中濃度上昇のおそれがある。[2.5参照]
- 9.3.2
- 中等度の肝機能障害のある患者
血漿中濃度上昇のおそれがある。[16.6.2参照]
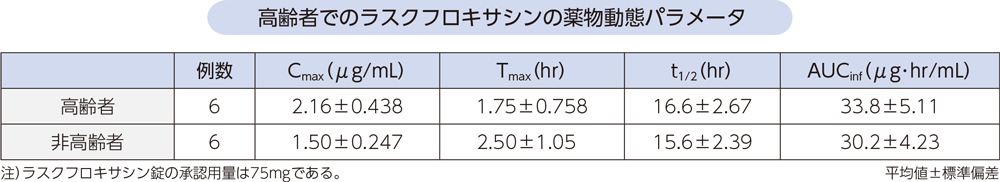
(7)高齢者2)[経口投与試験]
高齢者(6例:66~79歳)及び非高齢者(6例:32~36歳)にラスクフロキサシン200mgを単回経口投与したときの血漿中ラスクフロキサシンの薬物動態パラメータは以下のとおりであった。
2.5 重度の肝機能障害のある患者[9.3.1参照]
6. 用法及び用量
通常、成人にはラスクフロキサシンとして、投与初日に300mgを、投与2日目以降は150mgを1日1回点滴静注する。
- 9.
- 特定の背景を有する患者に関する注意〈抜粋〉
- 9.8
- 高齢者
- 9.8.1
- 腱障害があらわれやすいとの報告がある。[11.1.7参照]
- 9.8.2
- 患者の状態を十分に観察しながら慎重に投与すること。一般に高齢者では生理機能が低下している。本剤の臨床試験成績では、高齢者(65~91歳)において認められた副作用の種類及びその発現率は、非高齢者(16~64歳)と同様であった。
分布
(1)組織移行性2)[経口投与試験]
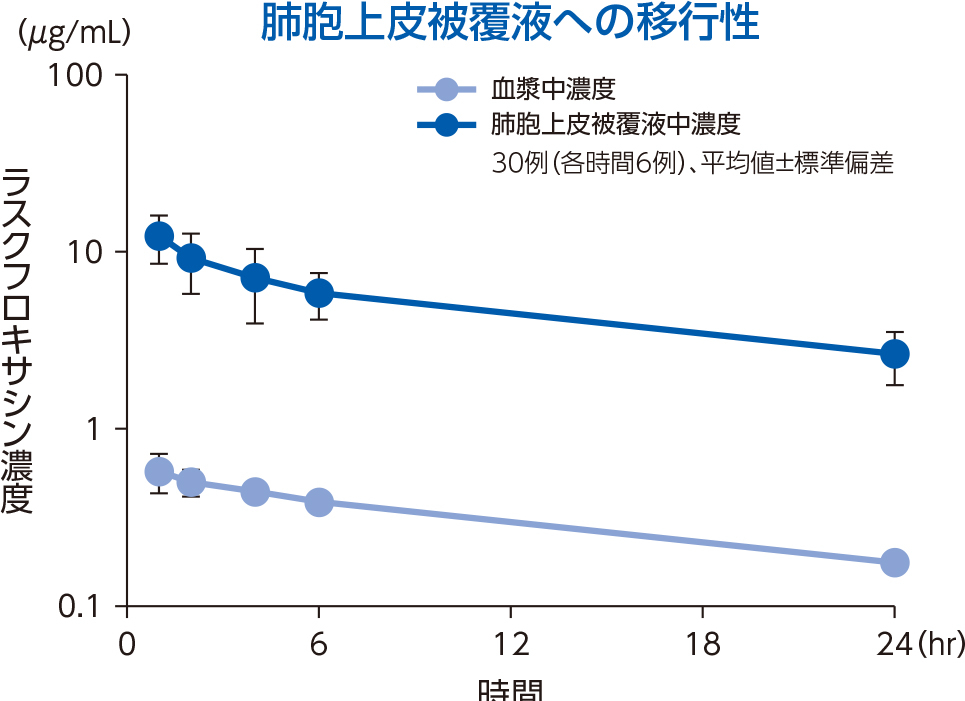
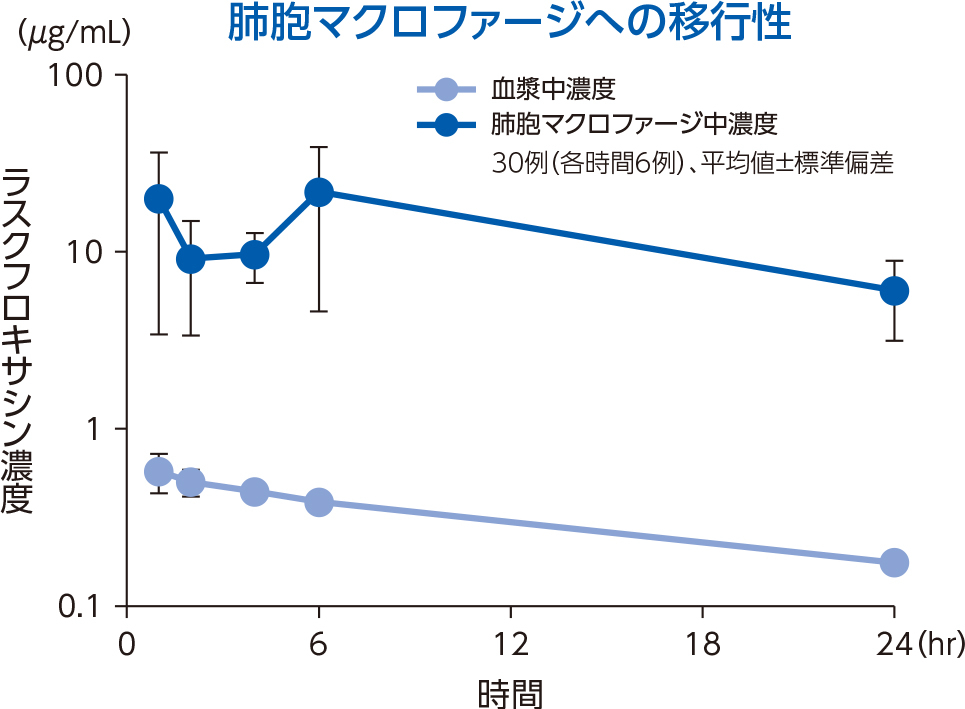
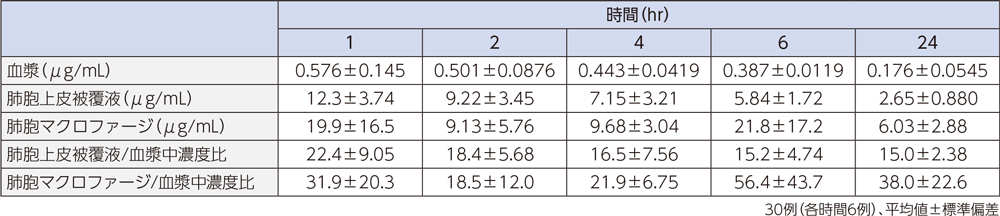
1)肺組織
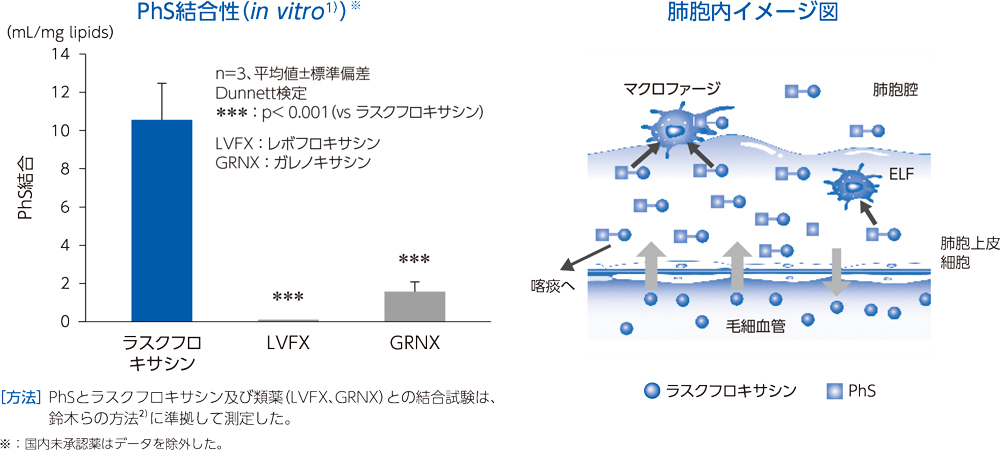
健康成人30例(各時間6例)にラスクフロキサシン75mgを単回経口投与後1~24時間での対血漿中濃度比は、肺胞上皮被覆液で平均15.0~22.4、肺胞マクロファージで平均18.5~56.4であった。
〈ラスクフロキサシンの肺組織移行性〉
肺胞上皮被覆液(Epithelial Lining Fluid:ELF)はリン脂質を多く含み、他の組織と比較するとホスファチジルセリン(PhS)の占める割合が高いことが知られている3)。ラスクフロキサシンは、ELF中のPhSと多く結合することで、上記の肺組織移行性を示したと考えられる。
2)喀痰
呼吸器感染症患者36例にラスクフロキサシン75mgを経口投与後1~3時間での対血漿中濃度比は喀痰で0.613±0.289(平均値±標準偏差)であった。
(2)蛋白結合率(in vitro4))
ラスクフロキサシン1~10μg/mLのin vitroでのヒト血漿蛋白結合率は71.2%~74.0%であった。
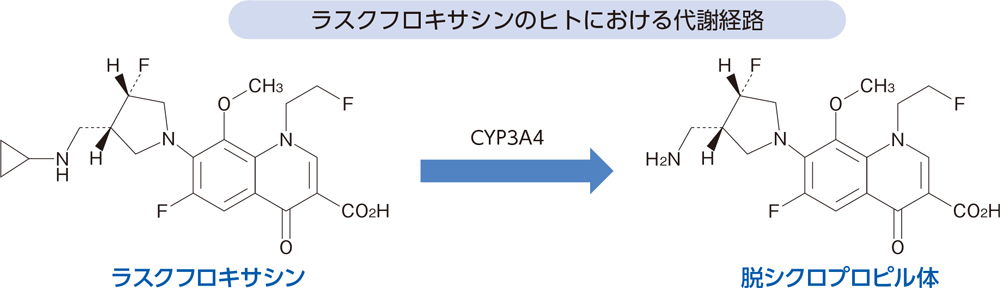
代謝(in vitro4)、健康成人2))[経口投与試験]
In vitroにおいてラスクフロキサシンはCYP3A4により脱シクロプロピル体に代謝された。
健康成人にラスクフロキサシン75mgを単回経口投与したとき、血漿中には主に未変化体が検出され、その他に脱シクロプロピル体が検出された。
排泄1、2)[点滴静注/経口投与試験]
健康成人に本剤150及び300mgを単回点滴静注したとき、投与開始後72時間の未変化体の尿中排泄率は、それぞれ12.2%及び14.2%であった。代謝物である脱シクロプロピル体ではそれぞれ34.3%及び28.3%、これら未変化体と脱シクロプロピル体の合計はそれぞれ46.4%及び42.5%であった。
健康成人にラスクフロキサシン75mgを単回経口投与したとき、投与後144時間までの未変化体の排泄率は、尿中に8.38%、糞中に16.0%であった。未変化体と脱シクロプロピル体の排泄率の合計は、尿中に39.9%、糞中に24.9%であった。
通常、成人にはラスクフロキサシンとして、投与初日に300mgを、投与2日目以降は150mgを1日1回点滴静注する。
薬物相互作用
(1)In vitro試験成績4)
ヒト肝ミクロソームを用いてCYP分子種の代謝活性に対するラスクフロキサシンの阻害効果を検討したところ、ラスクフロキサシンはCYP3A4及びCYP2C8を時間依存的に阻害した。ヒト凍結肝細胞を用いてCYP分子種に対するラスクフロキサシンの誘導能を検討したところ、CYP1A2及びCYP3A4に対する誘導作用が認められた。
また、各種トランスポータ発現細胞を用いてラスクフロキサシンの基質性を検討したところ、ラスクフロキサシンはP-糖タンパクの基質であった。同様にラスクフロキサシンの各種トランスポータに対する阻害効果を検討したところ、ラスクフロキサシンはMATE1及びMATE2-K発現細胞の基質輸送を阻害した。[10.参照]
(2)臨床試験成績2)[経口投与試験]
1)イトラコナゾールとの併用
健康成人5例にイトラコナゾール200mgとラスクフロキサシン75mgを経口にて併用投与したとき、ラスクフロキサシンのCmax及びAUClastはそれぞれ1.16倍及び1.46倍に増加した。
2)フェロジピンとの併用
健康成人12例にフェロジピン2.5mgとラスクフロキサシン200mgを経口にて併用投与したとき、フェロジピンのCmax及びAUClastはそれぞれ1.15倍及び1.62倍に増加した。
3)テオフィリンとの併用
健康成人6例にテオフィリン200mgとラスクフロキサシン150mgを経口にて併用投与したとき、テオフィリンのCmax及びAUC0-10はそれぞれ1.17倍及び1.18倍に増加した。[7頁 10.2参照]
4)モンテルカストとの併用
健康成人10例にモンテルカスト5mgとラスクフロキサシン150mgを経口にて併用投与したとき、モンテルカストのCmax及びAUClastはそれぞれ1.41倍及び1.94倍に増加した。
5)メトホルミンとの併用
健康成人8例にメトホルミン250mgとラスクフロキサシン150mgを経口にて併用投与したとき、メトホルミンのCmax及びAUClastに変化はなかった。
注)ラスクフロキサシン錠の承認用量は75mgである。
通常、成人にはラスクフロキサシンとして、投与初日に300mgを、投与2日目以降は150mgを1日1回点滴静注する。
- 1)承認時評価資料:ラスクフロキサシン(点滴静注)の臨床薬理試験.
- 2)承認時評価資料:ラスクフロキサシン(錠)の臨床薬理試験.
- 3)Nishiura A, et al., J Pharmacobiodyn. 10: 135-141(1987)
- 4)承認時評価資料:ラスクフロキサシンの薬物動態試験.
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

