-製品・患者指導情報-
日本標準商品分類番号:876241
医薬品リスク管理計画対象品
ラスビック点滴静注キットの製品基本情報-Product information-
2.禁忌(次の患者には投与しないこと)
- 2.1
- 本剤の成分又は他のキノロン系抗菌剤に対し過敏症の既往歴のある患者
- 2.2
- QT延長のある患者(先天性QT延長症候群等)[8.3、9.1.2、11.1.4参照]
- 2.3
- 低カリウム血症のある患者[9.1.2、11.1.4参照]
- 2.4
- クラスⅠA(キニジン、プロカインアミド等)又はクラスⅢ(アミオダロン、ソタロール等)の抗不整脈薬を投与中の患者[10.1参照]
- 2.5
- 重度の肝機能障害のある患者[9.3.1参照]
- 2.6
- 妊婦又は妊娠している可能性のある女性[9.5参照]
- 2.7
- 小児等[9.7参照]
3. 組成・性状
3.1 組成
| 薬液 (1バイアル24mL中) |
有効成分 | ラスクフロキサシン塩酸塩162.5mg(ラスクフロキサシンとして150mg) |
|---|---|---|
| 添加剤 | pH調整剤 | |
| 専用希釈液 (1容器76mL中) |
添加剤 | 塩化マグネシウム34.7mg、トロメタモール60mg、塩化ナトリウム860mg、pH調整剤 |
3.2 製剤の性状
| 薬液 | 専用希釈液 | 混合後 | |
|---|---|---|---|
| 剤形 | 注射剤 | ||
| 色調 | 微黄色澄明~淡黄色澄明の液 | 無色澄明の液 | 微黄色澄明~淡黄色澄明の液 |
| pH | 2.9~3.2 | 8.5~9.1 | 6.5~7.4 |
| 浸透圧比注) | 0.1以下 | 1.2~1.4 | 0.8~1.2 |
注)生理食塩液に対する比
4.効能又は効果
〈適応菌種〉
本剤に感性のブドウ球菌属、レンサ球菌属、肺炎球菌、腸球菌属、モラクセラ(ブランハメラ)・カタラーリス、大腸菌、クレブシエラ属、エンテロバクター属、インフルエンザ菌、レジオネラ・ニューモフィラ、ペプトストレプトコッカス属、ベイヨネラ属、バクテロイデス属、プレボテラ属、ポルフィロモナス属、フソバクテリウム属、肺炎マイコプラズマ(マイコプラズマ・ニューモニエ)
〈適応症〉
肺炎、肺膿瘍、慢性呼吸器病変の二次感染
6.用法及び用量
通常、成人にはラスクフロキサシンとして、投与初日に300mgを、投与2日目以降は150mgを1日1回点滴静注する。
8.重要な基本的注意
- 8.1
- 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
- 8.2
-
本剤によるショック、アナフィラキシーの発生を確実に予知できる方法がないので、次の措置をとること。[11.1.1参照]
・事前に既往歴等について十分な問診を行うこと。なお、抗生物質等によるアレルギー歴は必ず確認すること。
・投与に際しては、必ずショック等に対する救急処置のとれる準備をしておくこと。
・投与開始から投与終了後まで、患者を安静の状態に保たせ、十分な観察を行うこと。特に投与開始直後は注意深く観察すること。 - 8.3
- 本剤投与によりQT間隔が延長するおそれがあるため、本剤の投与開始前及び投与中は患者の状態を十分に観察し、必要に応じて心電図検査等を実施すること。[2.2、9.1.2、11.1.4参照]
- 8.4
- 大動脈瘤、大動脈解離を引き起こすことがあるので、観察を十分に行うとともに、腹部、胸部又は背部に痛み等の症状があらわれた場合には直ちに医師の診察を受けるよう患者に指導すること。[9.1.4、11.1.13参照]
9.特定の背景を有する患者に関する注意
- 9.1
- 合併症・既往歴等のある患者
- 9.1.1
-
てんかん等の痙攣性疾患又はこれらの既往歴のある患者
痙攣を起こすおそれがある。[11.1.10参照] - 9.1.2
-
重度の徐脈等の不整脈、虚血性心疾患、心不全等の心疾患のある患者
心室頻拍(Torsade de pointesを含む)、QT延長を起こすおそれがある。[2.2、2.3、8.3、11.1.4参照] - 9.1.3
-
重症筋無力症の患者
症状を悪化させるおそれがある。[11.1.12参照] - 9.1.4
-
大動脈瘤又は大動脈解離を合併している患者、大動脈瘤又は大動脈解離の既往、家族歴若しくはリスク因子(マルファン症候群等)を有する患者
必要に応じて画像検査の実施を考慮すること。海外の疫学研究において、フルオロキノロン系抗菌剤投与後に大動脈瘤及び大動脈解離の発生リスクが増加したとの報告がある。[8.4、11.1.13参照] - 9.3
- 肝機能障害患者
- 9.3.1
-
重度の肝機能障害のある患者
投与しないこと。血漿中濃度上昇のおそれがある。[2.5参照] - 9.3.2
-
中等度の肝機能障害のある患者
血漿中濃度上昇のおそれがある。[電子添文 16.6.2参照] - 9.5
-
妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験(ラット)で胎児への移行が報告されており、器官形成期に本剤を経口投与した群の胎児に発育遅延及び骨格異常(肋骨の短小)が認められている。[2.6参照] - 9.6
-
授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁中へ移行することが報告されている。 - 9.7
-
小児等
投与しないこと。動物実験(若齢イヌ)で関節軟骨障害が認められている。[2.7参照] - 9.8
- 高齢者
- 9.8.1
- 腱障害があらわれやすいとの報告がある。[11.1.7参照]
- 9.8.2
- 患者の状態を十分に観察しながら慎重に投与すること。一般に高齢者では生理機能が低下している。本剤の臨床試験成績では、高齢者(65~91歳)において認められた副作用の種類及びその発現率は、非高齢者(16~64歳)と同様であった。
10.相互作用
ラスクフロキサシンはCYP3A4の基質であり、CYP2C8に対し阻害作用を示す。[16.4、16.7.1参照]
10.1 併用禁忌(併用しないこと)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
本剤を併用した場合、相加的なQT延長がみられるおそれがあり、心室頻拍(Torsadesde pointesを含む)、QT延長を起こすことがある。 | これらの抗不整脈薬は単独投与でもQT延長作用がみられている。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
チアジド系利尿剤 |
低カリウム血症のある患者に本剤を投与した場合、心室頻拍(Torsade de pointesを含む)、QT延長を起こすことがある。 | これらの薬剤が有するカリウム排泄作用により、低カリウム血症を発現することがある。 |
|
痙攣を起こすおそれがある。症状が認められた場合、両剤の投与を中止するなど適切な処置を行うこと。 | 中枢神経におけるGABAA受容体への結合阻害が増強されると考えられている。 |
|
リファンピシン フェニトイン カルバマゼピン |
本剤の作用が減弱する可能性がある。 | CYP3A4を誘導する薬物と併用することにより本剤の血中濃度が低下する可能性がある。 |
| テオフィリン アミノフィリン水和物 [電子添文 16.7.2参照] |
テオフィリンの作用を増強させるおそれがあるので、併用する場合にはテオフィリンを減量するなど適切な処置を行うこと。 | 機序は不明であるが、本剤との併用によりテオフィリンの血中濃度が上昇する。 |
| レパグリニド | レパグリニドの血中濃度が上昇し、レパグリニドの副作用が発現するおそれがある。 | CYP2C8を阻害することにより、レパグリニドの血中濃度を上昇させる。 |
|
腱障害のリスクが増大するとの報告がある。これらの薬剤との併用は、治療上の有益性が危険性を上回る場合のみとすること。 | 機序不明 |
11.副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
- 11.1
- 重大な副作用
- 11.1.1
-
ショック、アナフィラキシー(いずれも頻度不明)
呼吸困難、血圧低下、浮腫、発赤等の症状が認められた場合には投与を中止し、適切な処置を行うこと。[8.2参照] - 11.1.2
- 白血球減少症(頻度不明)
- 11.1.3
-
間質性肺炎(0.3%)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎があらわれることがあるので、このような症状が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。 - 11.1.4
-
QT延長、心室頻拍(Torsade de pointesを含む)(いずれも頻度不明)
[2.2、2.3、8.3、9.1.2参照] - 11.1.5
- 低血糖(頻度不明)
- 11.1.6
-
偽膜性大腸炎等の血便を伴う重篤な大腸炎(頻度不明)
腹痛、頻回の下痢等が認められた場合には投与を中止し、適切な処置を行うこと。 - 11.1.7
-
アキレス腱炎、腱断裂等の腱障害(頻度不明)
腱周辺の痛み、浮腫、発赤等の症状が認められた場合には投与を中止し、適切な処置を行うこと。[9.8.1参照] - 11.1.8
-
肝機能障害(頻度不明)
肝機能障害(AST上昇、ALT上昇等)があらわれるおそれがある。 - 11.1.9
-
横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等を特徴とし、急激な腎機能悪化を伴う横紋筋融解症があらわれるおそれがある。 - 11.1.10
-
痙攣(頻度不明)
[9.1.1参照] - 11.1.11
- 錯乱、せん妄等の精神症状(頻度不明)
- 11.1.12
-
重症筋無力症の悪化(頻度不明)
[9.1.3参照] - 11.1.13
-
大動脈瘤、大動脈解離(いずれも頻度不明)
[8.4、9.1.4参照]
11.2 その他の副作用
| 5~10%未満 | 1~5%未満 | 1%未満 | |
|---|---|---|---|
| 精神神経系 | |||
| めまい | |||
| 消化器 | 下痢 | 便秘、悪心、嘔吐 | |
| 循環器 | 不整脈 | ||
| 血液 | 好酸球数増加、白血球数減少 | ||
| 皮膚 | 発疹 | ||
| 肝臓 | ALT上昇 | ||
| 腎臓 | 腎機能障害 | ||
| 血管障害 | 静脈炎 | ||
| 投与部位 | 注射部位紅斑 | 注射部位静脈炎、注射部位疼痛、注射部位反応 | 注射部位硬結、注射部位腫脹 |
14.適用上の注意
- 14.1
- 薬剤調製時の注意
- 14.1.1
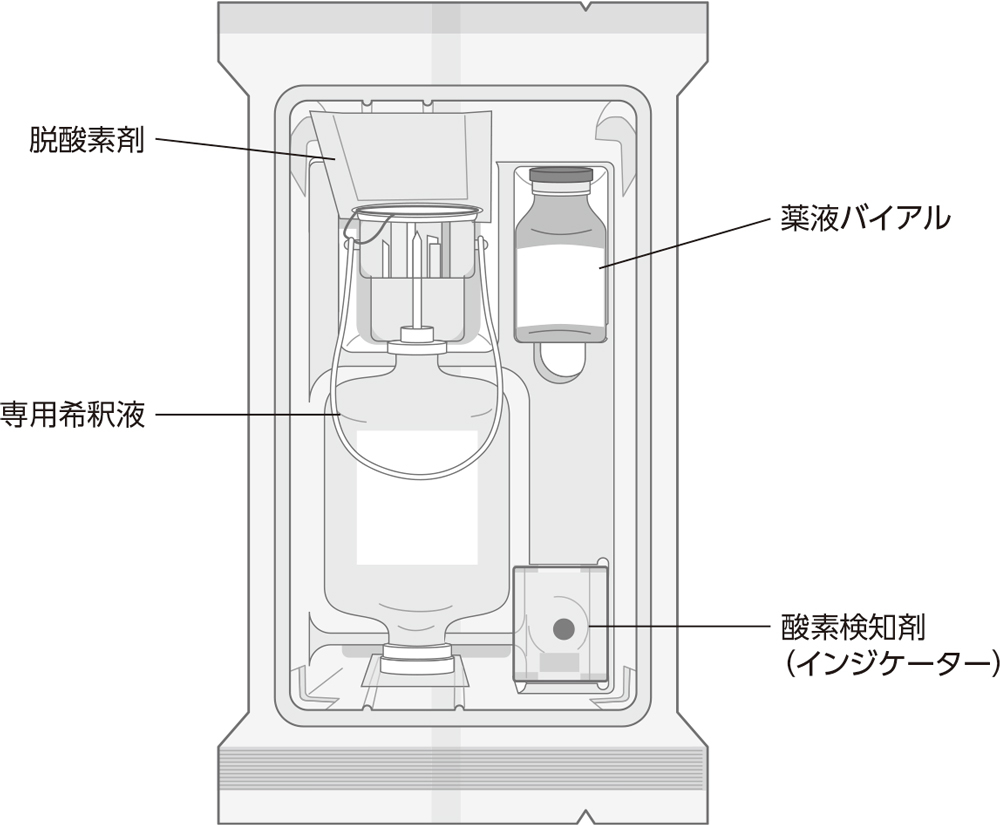
- 本剤は必ず薬液を専用希釈液で希釈(混合)して使用すること。
- 14.1.2
-
調製方法
薬液1本に対して、専用希釈液1本で希釈(混合)すること。
- (1)
- 薬液バイアルのキャップを外し、専用希釈液ボトルの支持筒上部のフィルムをはがす。
- (2)
- 支持筒上部を上に向けて薬液バイアルのゴム栓中央部に注入針をまっすぐ刺し、挿入完了位置まで一気に押し込む。
- (3)
- 接続操作にあたっては、支持筒等の固く安定する部分を持って行い、専用希釈液ボトルの胴部を持ったり、押さえたりしないこと。
- (4)
- 注入針が完全に奥まで刺し込まれていることを確認する。
- (5)
- 薬液バイアルを専用希釈液ボトルに接続後、薬液が専用希釈液ボトル側に落下しない場合は、ポンピングを行う。
- (6)
- 薬液がバイアルから専用希釈液ボトル側に全て流れたことを確認し、転倒混和する。薬液と専用希釈液を混合した後は室温で保管し、24時間以内に使用すること。
- (7)
- 栓体(排出口)への針刺しは、ゴム栓面に垂直にゆっくり行うこと。斜めに刺すと、ゴム片が薬剤中に混入したり、ポート部を傷つけ液漏れを起こすおそれがある。
20.取扱い上の注意
- 20.1
- 外箱を開封後、酸素検知剤を正常に働かせるため直射日光にさらさないこと。
- 20.2
- 内袋は使用するときまで開封しないこと。また、開封後は速やかに使用すること。
- 20.3
- 内袋開封前に酸素検知剤(ピンクの錠剤)の色を確認し、青紫~青色に変色している場合は、使用しないこと。
- 20.4
- 専用希釈液ボトルの支持筒上部及び栓体(排出口)をシールしているフィルムが万一はがれている時は使用しないこと。
21.承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22.包装
24mLバイアル
(76mL専用希釈液:注入針入り支持筒付き
プラスチック製容器付)
[脱酸素剤、酸素検知剤入り]:1キット
ラスビック点滴静注キット150mgの特性-Characteristic-
01POINT
02POINT
03POINT
04POINT
重大な副作用は、ショック、アナフィラキシー(いずれも頻度不明)、白血球減少症(頻度不明)、間質性肺炎(0.3%)、QT延長、心室頻拍(Torsade de pointesを含む)(いずれも頻度不明)、低血糖(頻度不明)、偽膜性大腸炎等の血便を伴う重篤な大腸炎(頻度不明)、アキレス腱炎、腱断裂等の腱障害(頻度不明)、肝機能障害(頻度不明)、横紋筋融解症(頻度不明)、痙攣(頻度不明)、錯乱、せん妄等の精神症状(頻度不明)、重症筋無力症の悪化(頻度不明)、大動脈瘤、大動脈解離(いずれも頻度不明)が報告されています。
主な副作用は、注射部位紅斑12例3.9%、下痢11例3.6%、注射部位疼痛、注射部位静脈炎、注射部位腫脹各6例2.0%でした。(承認時)
詳細は電子添文の副作用及び臨床成績の安全性の結果をご参照ください。
-
※:〈適応菌種〉
本剤に感性のブドウ球菌属、レンサ球菌属、肺炎球菌、腸球菌属、モラクセラ(ブランハメラ)・カタラーリス、大腸菌、クレブシエラ属、エンテロバクター属、インフルエンザ菌、レジオネラ・ニューモフィラ、ペプトストレプトコッカス属、ベイヨネラ属、バクテロイデス属、プレボテラ属、ポルフィロモナス属、フソバクテリウム属、肺炎マイコプラズマ(マイコプラズマ・ニューモニエ)
〈適応症〉
肺炎、肺膿瘍、慢性呼吸器病変の二次感染