-安全性-
安全性薬理試験1)

毒性試験2)
(1)単回投与毒性試験

(2)反復投与毒性試験
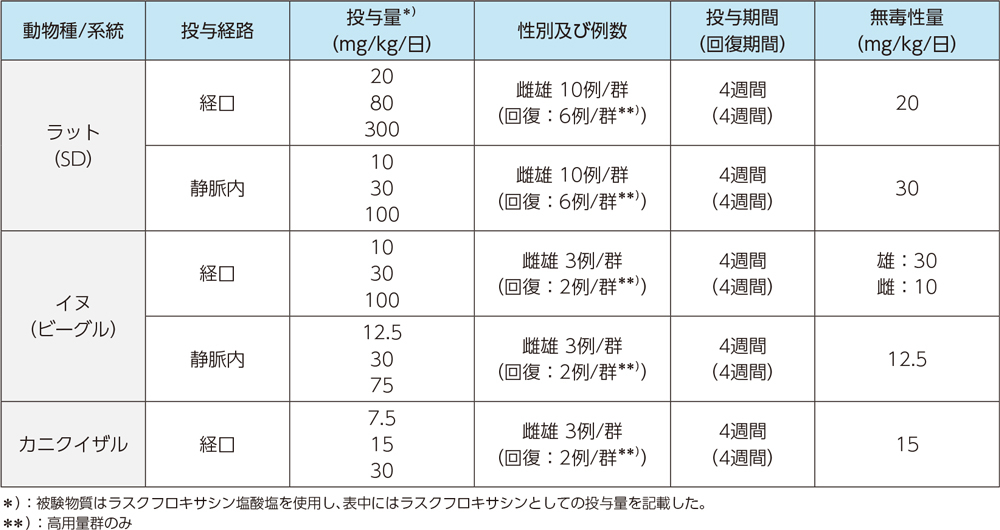
(3)生殖発生毒性試験
1)受胎能及び着床までの初期胚発生に関する試験
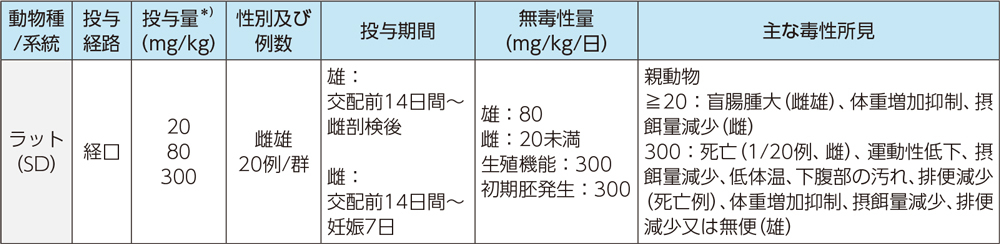
2)胚・胎児発生に関する試験
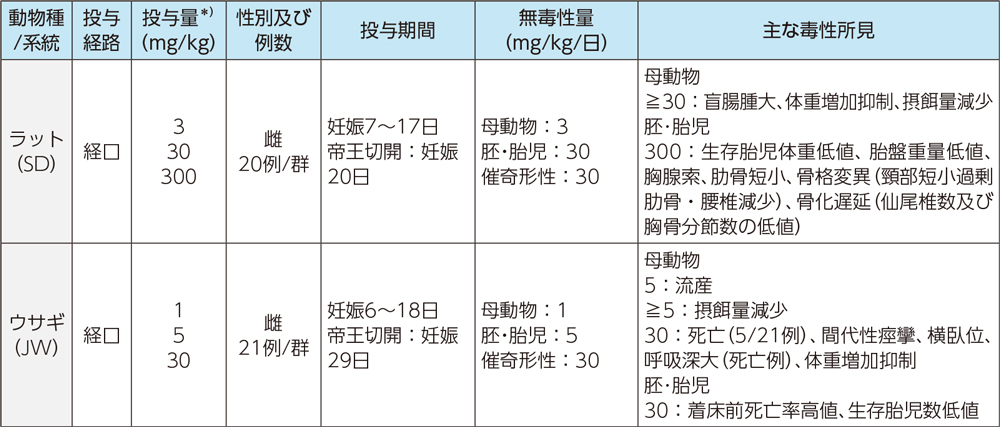
3)出生前及び出生後の発生並びに母体の機能に関する試験
(4)その他の特殊毒性試験
1)遺伝毒性試験
ラスクフロキサシンのin vitro試験では、細菌を用いる復帰突然変異試験は陰性、ほ乳類培養細胞を用いる染色体異常試験及びマウスリンフォーマTk試験はいずれも陽性であった。一方、ラットを用いたin vivo試験では、小核試験、不定期DNA合成試験及び遺伝子突然変異試験、いずれも陰性であった。ラットに小核誘発作用が認められなかった。
2)がん原性試験
雌雄rasH2マウスにラスクフロキサシンを26週間反復経口投与し、がん原性を評価した。雌雄ともにいずれの組織・器官に対してもがん原性が認められなかった。
3)光毒性試験
雄有色ラット(Long-Evans)にラスクフロキサシン100及び1,000mg/kgを単回経口投与後、投与3時間後より長波長紫外線(UVA)約10J/cm2を120分間照射。照射0.5、24、48及び72時間後に耳介及び背部皮膚の観察。照射72時間後に眼科的検査及び眼球の病理組織学的検査を実施した結果、耳介及び背部の皮膚反応、耳介厚、眼科的検査及び眼球の病理組織学的検査に異常はなく、光毒性反応は認められなかった。
4)関節毒性試験
ラスクフロキサシンは、ラット*1及びサル*2の反復投与毒性試験で関節への影響は認められなかったが、若齢イヌ(投与開始時6ヵ月齢)*3の2週間及び4週間反復投与毒性試験で、大腿骨又は上腕骨の関節軟骨にブリスターや関節腔の滑液増加が観察された。成熟イヌ(投与開始16ヵ月齢:雄ビーグル)*4にラスクフロキサシン30、75mg/kgを2週間反復静脈内投与して関節への影響を検討したが、各関節に異常は観察されず、成熟イヌにおける関節に対する無毒性量は75mg/kgと判断した。
*1:経口及び静脈内投与、*2:経口投与、*3:経口及び静脈内投与、*4:静脈内投与
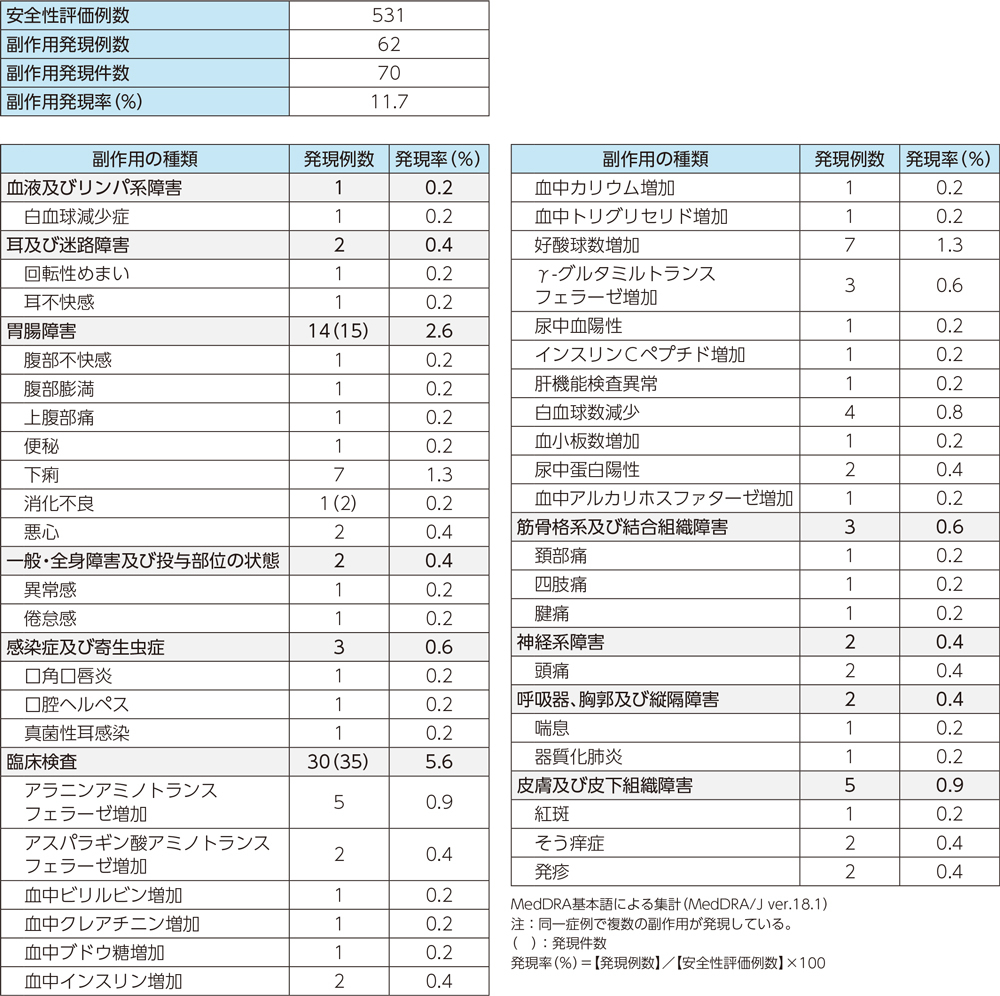
臨床試験(副作用)
国内で実施された臨床試験において、531例中62例(11.7%)に副作用(臨床検査値異常を含む)が認められた。
主な副作用は、下痢、好酸球数増加各7例(1.3%)、ALT上昇5例(0.9%)であった。(承認時)
- 1)承認時評価資料:ラスクフロキサシンの安全性薬理試験.
- 2)承認時評価資料:ラスクフロキサシンの毒性試験.
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

