-安全性-
◆安全性
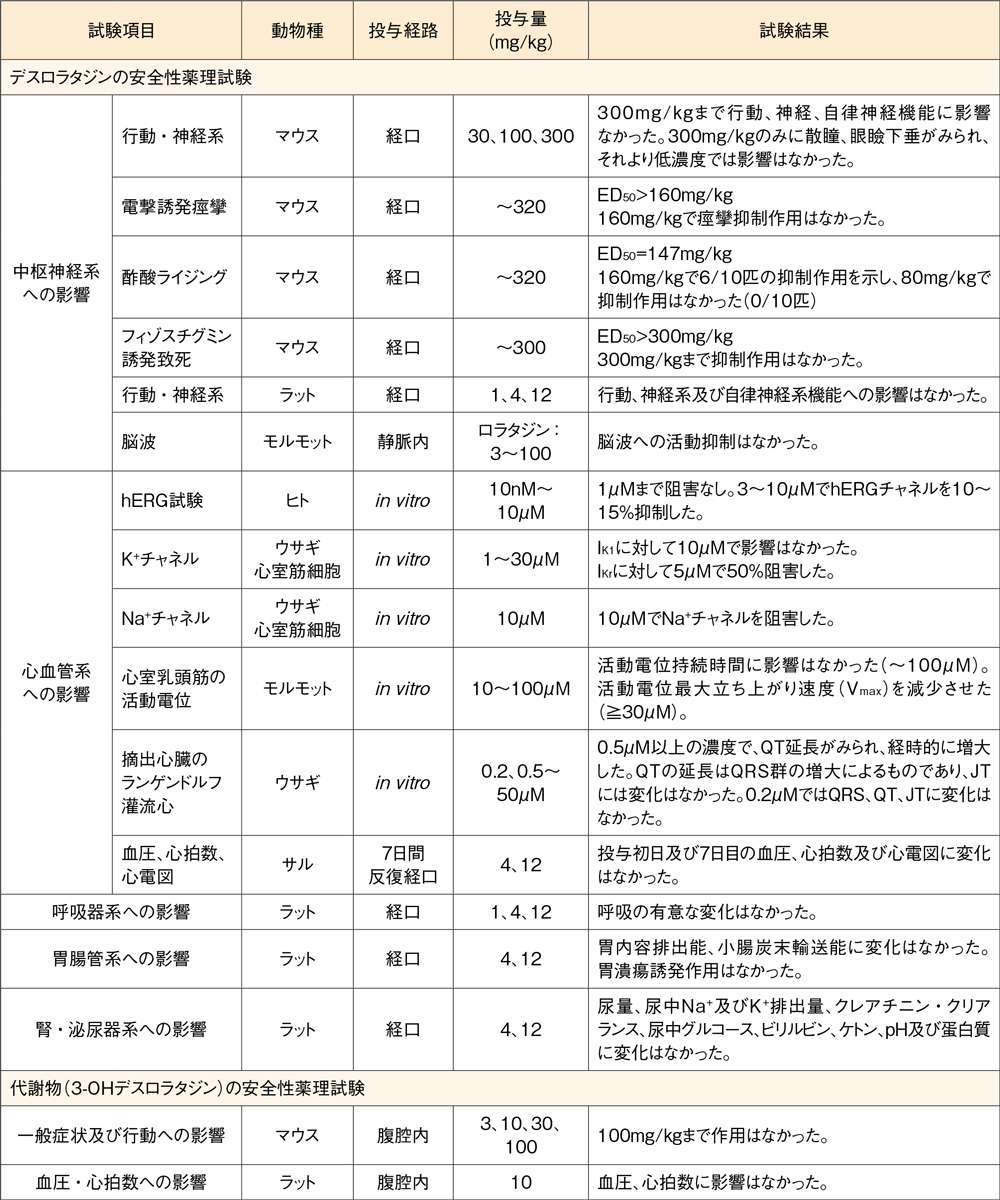
1.安全性薬理試験1)
2.毒性試験2)
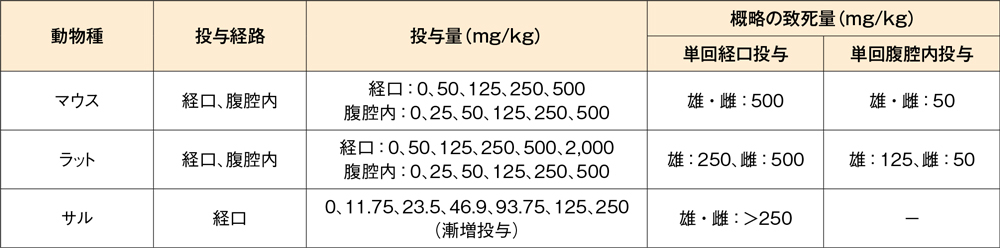
単回投与毒性試験(マウス、ラット、サル)
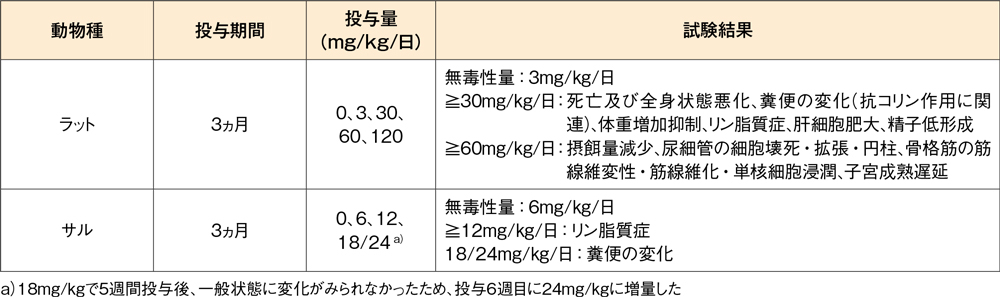
反復経口投与毒性試験(ラット、サル)
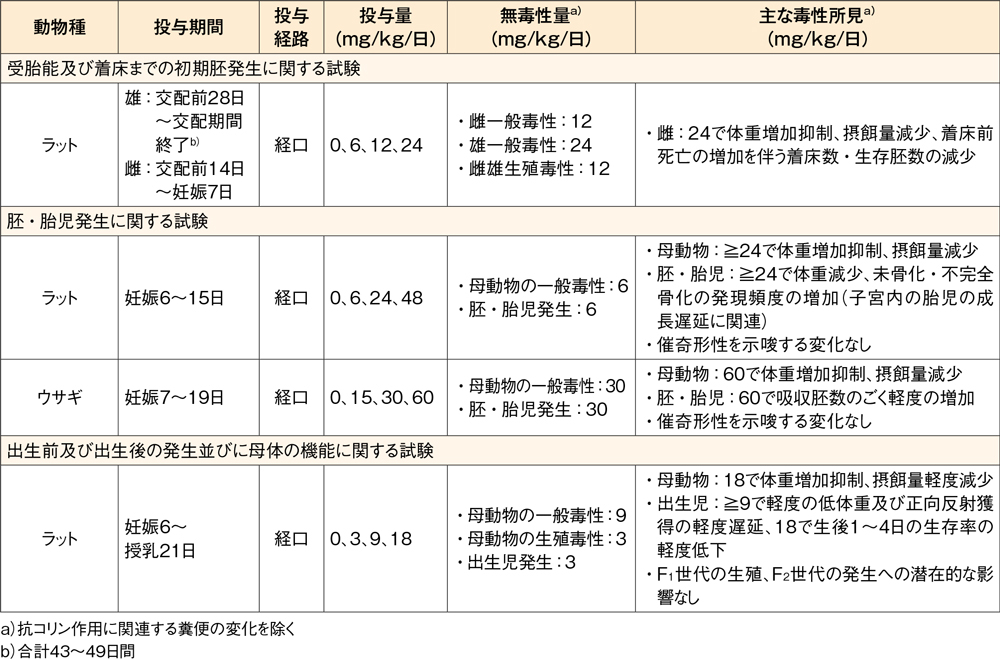
生殖発生毒性試験(ラット、ウサギ)
その他の特殊毒性
遺伝毒性(in vitro 、ヒト、マウス)
ネズミチフス菌及び大腸菌を用いた復帰突然変異試験、ヒト末梢血リンパ球を用いた染色体異常試験及びマウス骨髄の多染性赤血球を用いた小核試験において、細胞毒性又は骨髄毒性が認められる用量まで検討しましたが、いずれの試験方法においても、遺伝毒性は認められませんでした。
がん原性(マウス)
マウスにデスロラタジンを2年間投与したがん原性試験では、最大耐量を超えると考えられる用量(高用量での曝露量は臨床曝露量の1,084倍に相当)まで投与しましたが、がん原性を示唆する変化は認められませんでした。
代謝物の毒性(in vitro 、マウス)
デスロラタジンのヒトにおける主要代謝物である3-OHデスロラタジンのネズミチフス菌及び大腸菌を用いた復帰突然変異試験及びマウス骨髄の多染性赤血球を用いた小核試験において、細胞毒性又は骨髄毒性が認められる用量まで検討しましたが、いずれの試験方法においても遺伝毒性は認められませんでした。
6.用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。- 1)社内資料(一般薬理試験)
- 2)社内資料(毒性試験)
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。


