-安全性-
安全性薬理試験1)


毒性試験2)
単回投与毒性試験

反復投与毒性試験

生殖発生毒性試験
- (1)
- 受胎能及び着床までの初期胚発生、並びに出生前及び出生後の発生並びに母体の機能に関する試験

- (2)
- 胚・胎児発生に関する試験

その他の特殊毒性試験
- (1)
- 遺伝毒性試験

- (2)
- がん原性試験

a:マウスの体重を30gとして換算
- (3)
- 局所刺激性試験

臨床試験(安全性)
国内第Ⅲ相多施設共同無作為化二重盲検プラセボ対照並行群間比較試験3)
本試験開始時に発行されていた間質性膀胱炎(IC)診療ガイドラインでは、ICはハンナ病変を有するハンナ型と、ハンナ病変は有さないが点状出血又は拡張後粘膜出血がある非ハンナ型とに分類されていたため、本試験はハンナ型及び非ハンナ型のいずれも組み入れ対象となっています。承認時評価資料であるため、承認外の非ハンナ型を含めた試験成績を記載しています。
試験概要
| 目的 |
主要目的: 日本人間質性膀胱炎患者を対象として、投与後12週のO'Leary & Sant間質性膀胱炎症状スコア(ICSI)のベースラインからの変化量について、ジムソ群のプラセボ群に対する優越性を検証する。 副次的目的: 副次的評価項目について、ジムソ群のプラセボ群に対する優越性を検討する。また、日本人間質性膀胱炎患者を対象として、ジムソ®膀胱内注入液50%を2週間間隔で6回膀胱内注入した際の安全性を検討する。 |
|---|---|
| 対象 |
日本人間質性膀胱炎患者* 96例
|
| 試験デザイン |
多施設共同無作為化二重盲検プラセボ対照並行群間比較試験 |
| 方法 |
観察期(2週間)にプラセボ50mLを単回膀胱内注入した。ICSIスコアを割付け因子とした動的割付けにより、被験者をジムソ群又はプラセボ群のいずれかに1:1の比で無作為に割付け、それぞれジムソ®膀胱内注入液50%50mL又はプラセボ50mLを2週間間隔で6回膀胱内注入した。投与方法は、経尿道的に膀胱内に挿入されたカテーテルから、治験薬を膀胱内に注入し、可能な限り15分間以上膀胱内に保持させた後、自然排尿させることとした。 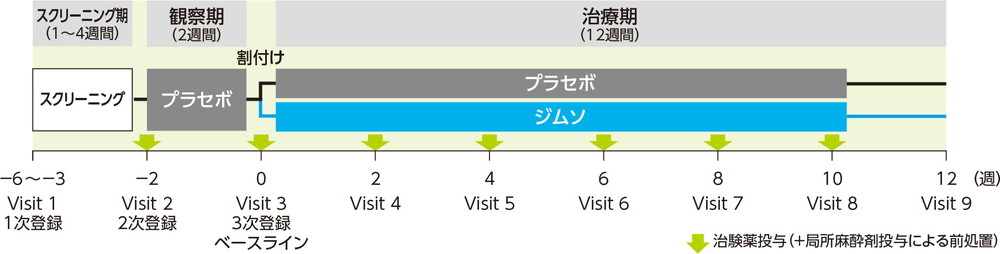
|
| 評価項目 |
|
安全性
副作用発現率
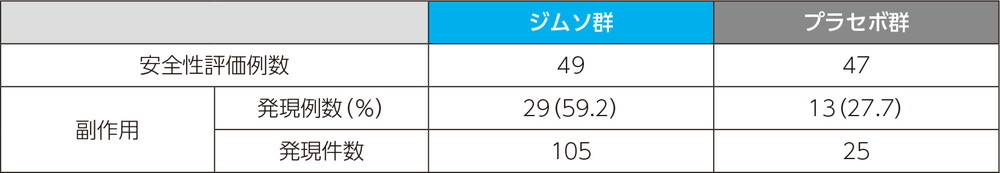
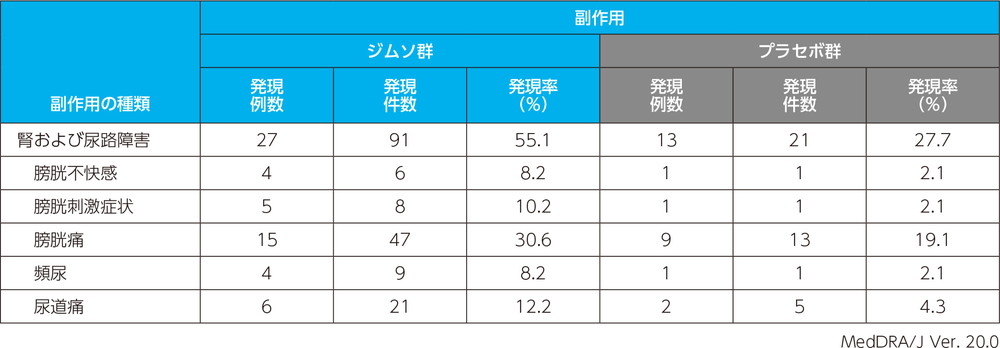
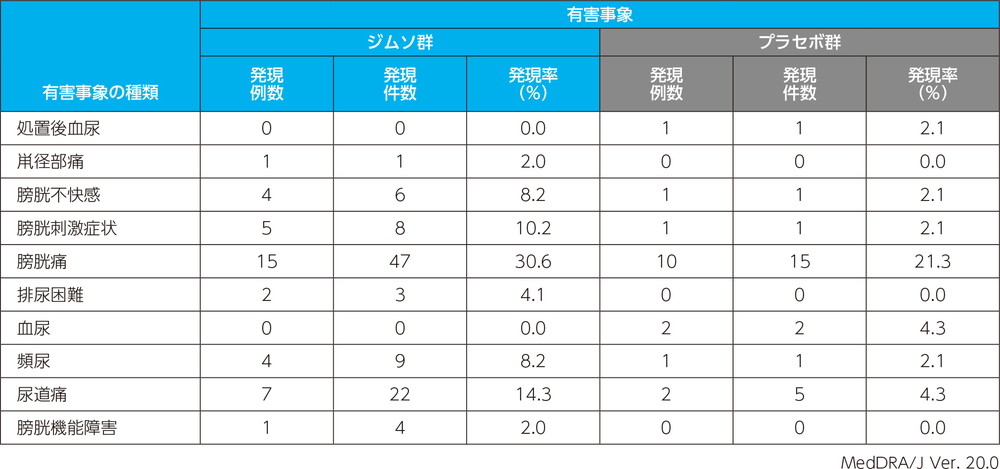
主な副作用(いずれかの投与群で発現例数3例以上)
投与中止に至った副作用は、プラセボ群で発疹が1例1件であった。本試験においては死亡例、重篤な副作用は認められなかった。
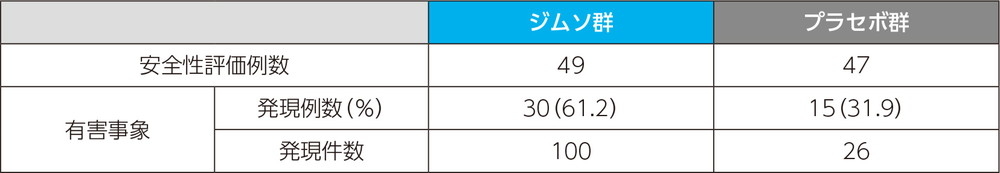
注目すべき有害事象
投与時反応に関する有害事象
・投与時反応に関する有害事象の治験薬投与回数別の発現割合
ジムソ群及びプラセボ群ともに初回投与後の発現割合が最も高く、それぞれ53.1%(26/49例)及び23.4%(11/47例)であった。2回目投与後以降の発現割合は、ジムソ群及びプラセボ群ともに初回投与後と比べて低かった。
・投与時反応に関する有害事象の各治験薬投与日から発現日までの経過日数
中央値は、ジムソ群及びプラセボ群ともにいずれの投与回数でも1日であった。また、投与時反応に関する有害事象の発現から転帰確認までの経過日数の全投与回数での中央値は、ジムソ群では2日、プラセボ群では1日であった。
- 8.
-
重要な基本的注意
投与時反応(膀胱痛、尿道痛、膀胱刺激症状、膀胱不快感等)があらわれることがあるため、必要に応じて、本剤投与前に局所麻酔剤の膀胱内注入を行った上で投与すること。
呼気・皮膚の異常臭に関する有害事象
呼気・皮膚の異常臭に関する有害事象の発現割合はジムソ群で6.1%(3/49例)であり、呼気臭が2例3件、皮膚臭異常が1例1件であった。呼気・皮膚の異常臭に関する有害事象はいずれも治験責任医師等により治験薬との因果関係が否定できないと判断された。
水晶体障害に関する有害事象
呼気・皮膚本試験においては水晶体障害に関する有害事象は認められなかった。
- 15.
- その他の注意
- 15.2
- 非臨床試験に基づく情報(抜粋)
- 15.2.1
- ラット(9.9g/kg/日、経口)及びイヌ(1.1、3.3、9.9g/kg/日、経口)の反復投与毒性試験において、ラットでは投与18箇月後、イヌでは1.1g/kg群で投与31週後に、3.3及び9.9g/kg群では投与10週後に眼の変化(水晶体の混濁又は屈折率の変化)が認められたとの報告がある。
- 1) 社内資料:安全性薬理試験
- 2) 社内資料:毒性試験
- 3) 承認時評価資料:日本人間質性膀胱炎患者を対象とした多施設共同、無作為化、二重盲検、プラセボ対照、並行群間比較試験(KRP116D-L301試験)
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

