-安全性-
安全性薬理試験1)
いずれの所見もβ2刺激薬の既知の薬理作用であると考えられた。

毒性試験2)
反復投与毒性試験及び生殖発生毒性試験ともに、個々の薬剤の薬理作用に起因した変化が主であった。いずれの変化ともに、既に承認されているフルチカゾンの吸入剤及びホルモテロールの経口剤で報告されているものであり、配合剤に起因した新たな毒性徴候は認められなかった。
(1)反復投与毒性試験
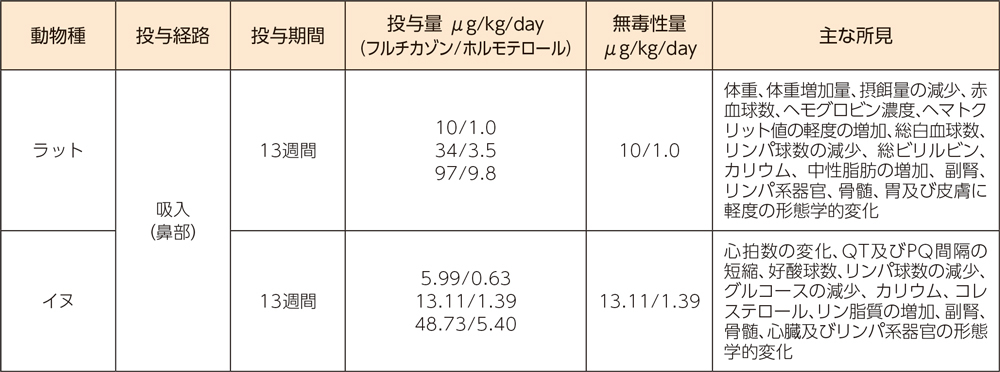
(2)反復投与毒性試験 ブリッジング試験

(3)生殖発生毒性試験
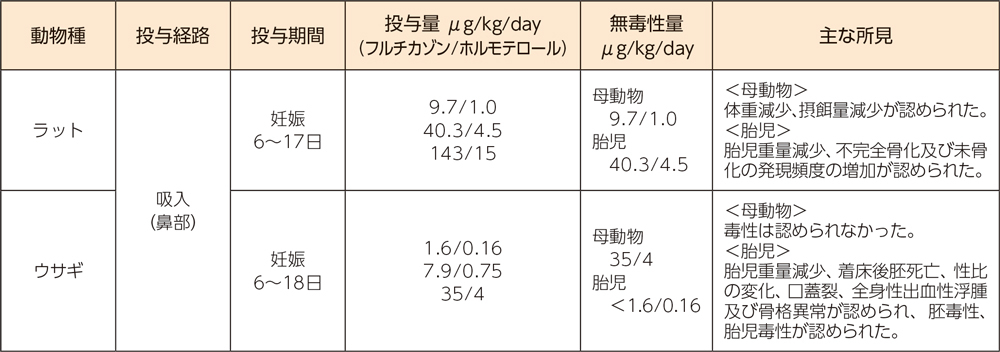
- フルチカゾン
- :フルチカゾンプロピオン酸エステル
- ホルモテロール
- :ホルモテロールフマル酸塩水和物
臨床試験(安全性)
国内第Ⅲ相単盲検比較試験〈成人〉3)
| 目的 |
フルティフォーム®の有効性及び安全性をフルチカゾンプロピオン酸エステル(FP)エアゾール製剤との比較により検討する。 |
|---|---|
| 対象 |
16歳以上の気管支喘息患者455例 選択基準
など |
| 方法 |
無作為化単盲検並行群間比較試験。2週間の観察期間の後、フルティフォーム®群とFP群に割付け、8週間投与した。 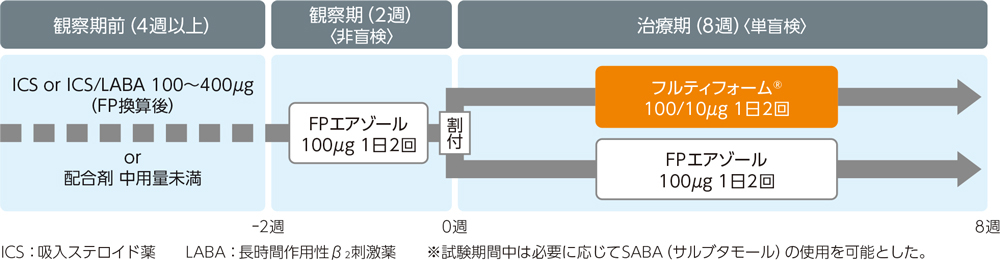
|
| 評価項目 |
|
| 安全性 |
フルティフォーム®群の有害事象は228例中82例(36.0%)、副作用は228例中22例(9.6%)であった。 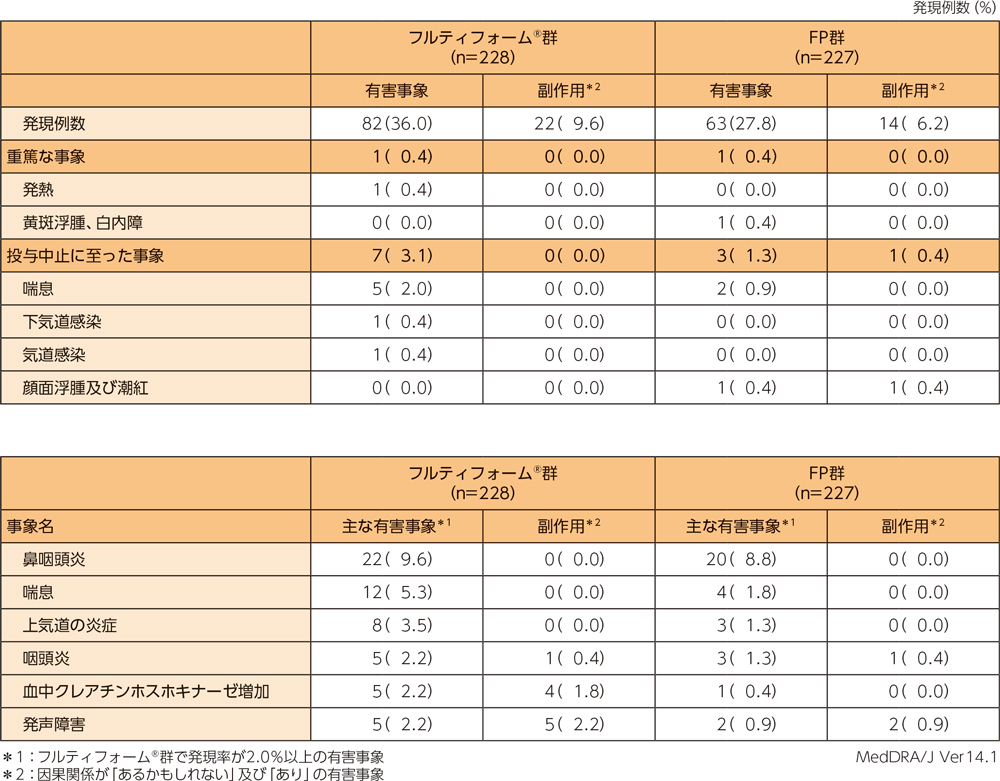
|
国内第Ⅲ相長期投与試験〈成人〉4)5)
| 目的 |
フルティフォーム®の52週間長期投与による安全性及び有効性を検討する。 |
|---|---|
| 対象 |
16歳以上の気管支喘息患者244例(完了被験者214例) |
| 方法 |
非盲検非対照試験。2週間の観察期間の後、観察期で使用した吸入ステロイド薬(ICS)の用量に基づき、低用量群、中用量群、高用量群に割付け、52週間投与した。また、治療期間中、増量又は減量基準に合致した場合には、増量又は減量を可能とした。 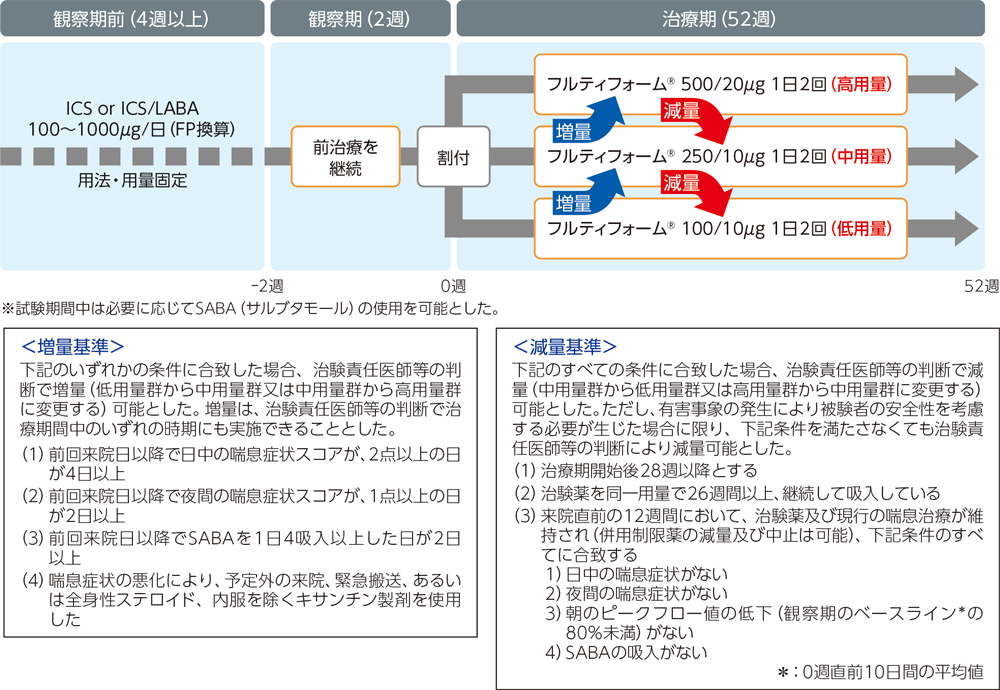
|
| 評価項目 |
|
| 解析計画 |
|
| 安全性 |
有害事象は244例中225例(92.2%)、副作用は244例中79例(32.4%)に認められた。 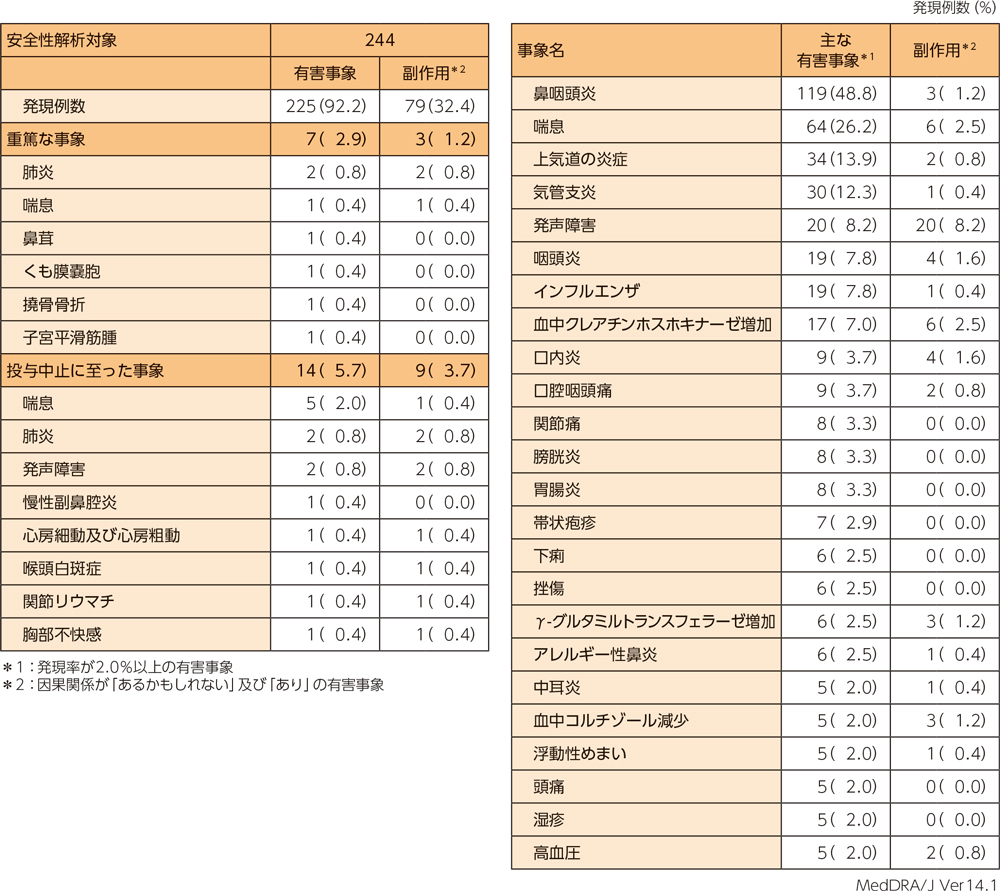
|
-
5.1.患者、保護者又はそれに代わる適切な者に対し次の注意を与えること。
本剤は発現した発作を速やかに軽減する薬剤ではないので、急性の発作に対しては使用しないこと。 - 5.2.本剤の投与開始前には、患者の喘息症状を比較的安定な状態にしておくこと。特に、喘息発作重積状態又は喘息の急激な悪化状態のときには原則として本剤は使用しないこと。
7. 効能又は効果に関連する注意
- 症状の緩解がみられた場合は、治療上必要最小限の用量を投与し、必要に応じ吸入ステロイド剤への切り替えも考慮すること。
国内第Ⅲ相非盲験クロスオーバー比較試験〈小児〉6)
| 目的 |
フルティフォーム®群のフルチカゾン/サルメテロール配合剤(SFC)群に対する非劣性を検証する。またフルティフォーム®群の有効性及び安全性をSFC群と比較する。 |
|---|---|
| 対象 |
5歳以上16歳未満の小児気管支喘息患者87例 |
| 方法 |
多施設共同、実薬対照、無作為化、非盲検、2群2期クロスオーバー比較試験。フルティフォーム®50/5μg又はフルチカゾン/サルメテロール配合剤50/25μgエアゾールをそれぞれ1回2吸入、1日2回、各治療期2週間投与した。投与順1はフルティフォーム®群→SFC群、投与順2はSFC群→フルティフォーム®群とし、年齢を割付因子とした動的割付けを行った。観察期及び休薬期は、観察期前のICS用量を目安にFP(フルチカゾン)エアゾールを100μg/日又は200μg/日投与した。治療期1開始日に、治療期1移行基準を満たした被験者を投与順1又は投与順2に1:1の比で無作為に割り当てた。 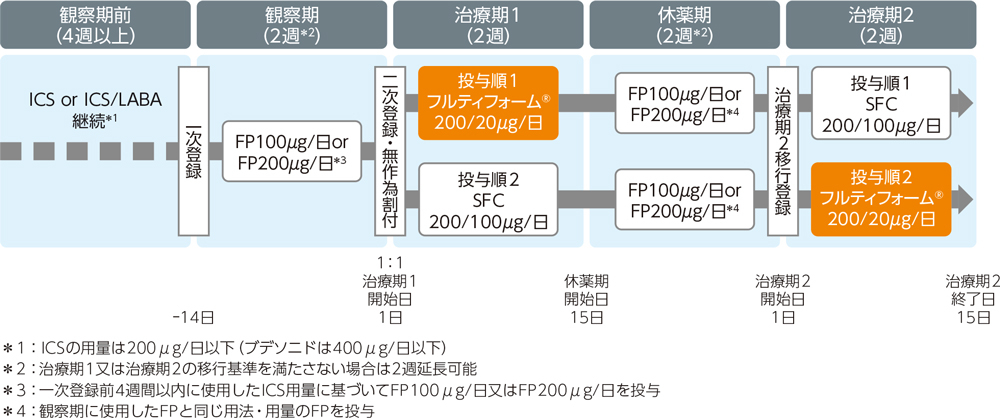
|
| 評価項目 |
安全性評価項目 |
| スペーサーの使用 |
被験者が治験薬及びフルチカゾンプロピオン酸エステル エアゾールを吸入する際には、スペーサーの使用を必須とした。また、本治験で使用するスペーサーは、エアロチャンバー(トゥルーデルメディカル社製)とし、マウスピースタイプ、又はマスクタイプのいずれかを治験責任医師等の判断で選択した。なお、サルブタモール吸入時にはスペーサーの使用を必須としないが、可能な限り使用の有無を統一させた。 |
| 安全性 |
フルティフォーム®群の有害事象は81例中21例(25.9%)、副作用は81例中2例(2.5%)であった。フルティフォーム®群の主な有害事象は以下のとおりであり、副作用の内訳は頭痛、振戦が各1例であった。本試験において、投与中止に至った有害事象、重篤な有害事象及び死亡例は認められなかった。 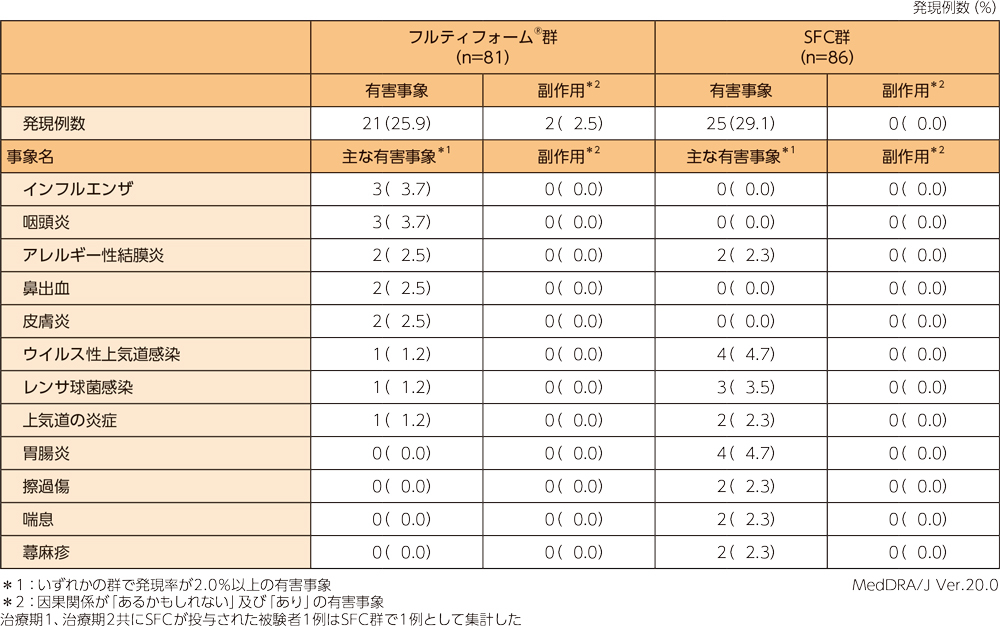
|
9.7 小児等
- 9.7.1.長期間投与する場合には、身長等の経過の観察を十分行うこと。また使用にあたっては、使用法を正しく指導すること。全身ステロイド剤と比較し可能性は低いが、吸入ステロイド剤を特に長期間、大量に投与する場合に成長遅延をきたすおそれがある。なお、小児等に対しては国内での24週間を超える臨床試験は実施していない。
- 9.7.2.低出生体重児、新生児、乳児又は5歳未満の幼児を対象とした臨床試験は実施していない。
国内第Ⅲ相長期投与試験〈小児〉7)
| 目的 |
フルティフォーム®50/5μgを1回2吸入、1日2回、24週間投与したときの安全性及び有効性を検討する。 |
|---|---|
| 対象 |
5歳以上16歳未満の日本人小児気管支喘息患者53例
|
| 方法 |
多施設共同、非盲検、非対照、長期投与試験。吸入ステロイド薬(ICS)を4週間以上前から用法・用量を変更せず使用を継続した患者に対して、観察期として観察期開始前と同じICSを同用量・用法・剤形で2週間継続使用した。治療期移行基準を満たした被験者は、治療期としてフルティフォーム®50/5μgを1回2吸入、1日2回、朝・夜吸入した。 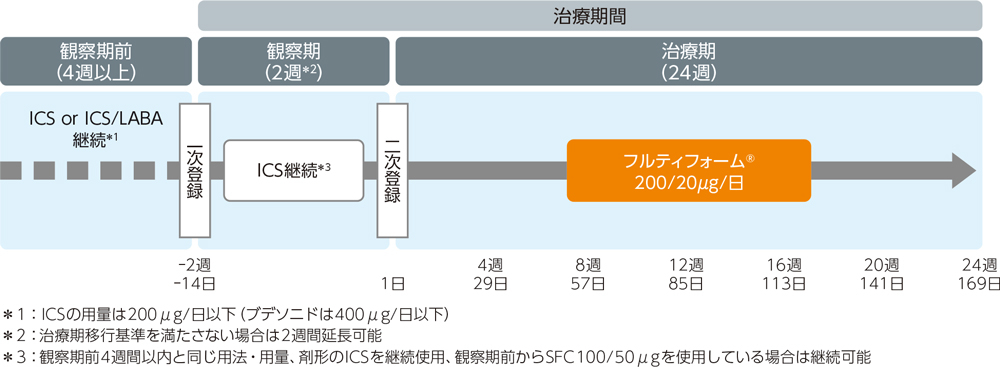
|
| 評価項目 |
安全性評価項目 |
| 統計解析 |
安全性評価項目 |
| スペーサーの使用 |
pMDI製剤の使用経験がない場合はスペーサーの使用を必須とし、pMDI製剤の使用経験がある場合は治験責任医師等がスペーサーの要否を決定した。スペーサーの使用が必須と判断された被験者でも、その後の来院時にプラセボ吸入確認を行い、治験責任医師等がスペーサー不要と判断した場合は、使用をやめることができた。 |
| 安全性 |
有害事象は、53例中39例(73.6%)、副作用は53例中5例(9.4%)に認められた。 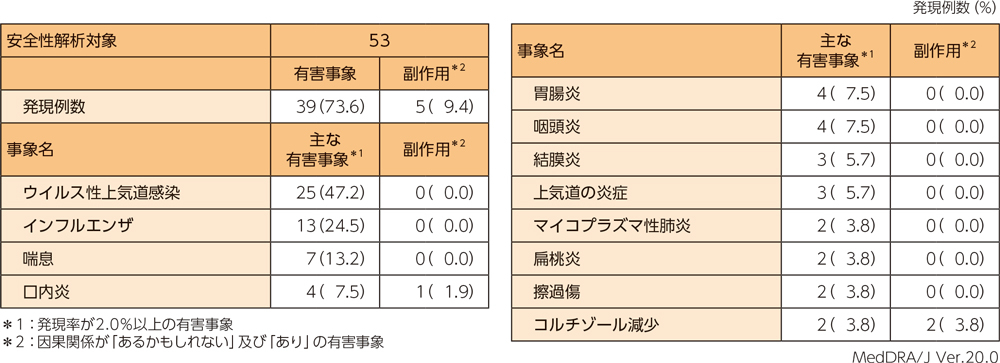 |
9.7 小児等
- 9.7.1.長期間投与する場合には、身長等の経過の観察を十分行うこと。また使用にあたっては、使用法を正しく指導すること。全身ステロイド剤と比較し可能性は低いが、吸入ステロイド剤を特に長期間、大量に投与する場合に成長遅延をきたすおそれがある。なお、小児等に対しては国内での24週間を超える臨床試験は実施していない。
- 9.7.2.低出生体重児、新生児、乳児又は5歳未満の幼児を対象とした臨床試験は実施していない。
- 1)フルティフォーム®の安全性薬理(社内資料)
- 2)フルティフォーム®の毒性(社内資料)
- 3)フルティフォーム®の国内第Ⅲ相単盲検比較試験〈成人〉(承認時評価資料).
- 4)フルティフォーム®の国内第Ⅲ相長期投与試験〈成人〉(承認時評価資料).
- 5)東田有智 他. アレルギー・免疫 20; 1686, 2013.
利益相反:本研究は杏林製薬株式会社の支援により行われた。 - 6)フルティフォーム®の国内第Ⅲ相非盲検クロスオーバー比較試験〈小児〉(承認時評価資料).
- 7)フルティフォーム®の国内第Ⅲ相長期投与試験〈小児〉(承認時評価資料)
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

