-薬物動態-
吸収1)
1. 単回投与試験
日本人健康成人男性6例を対象として、ペンタサ坐剤1gを空腹時に単回投与したとき、血漿中メサラジン未変化体及びアセチル体の濃度推移を下図に、また薬物動態パラメータを下表に示しました。
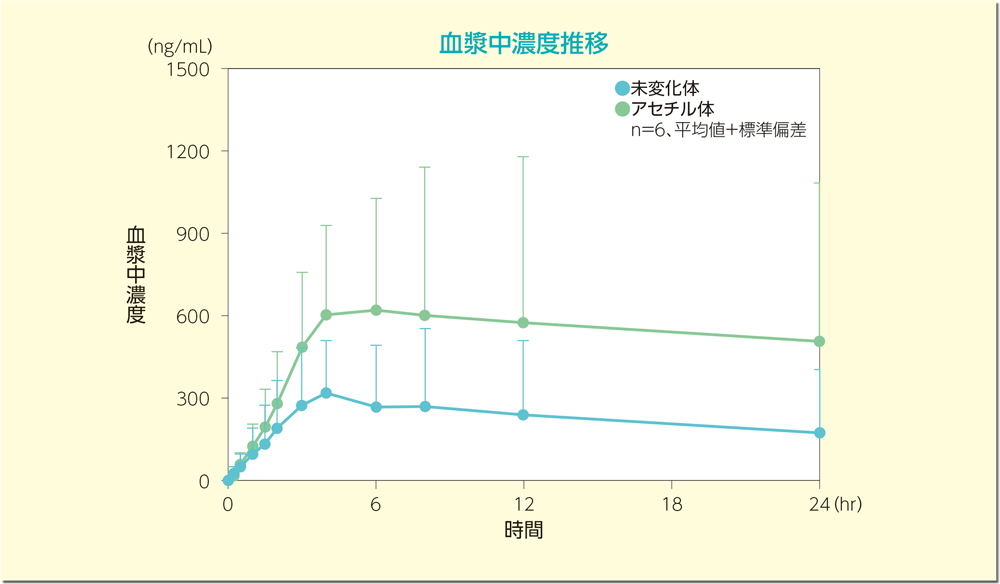
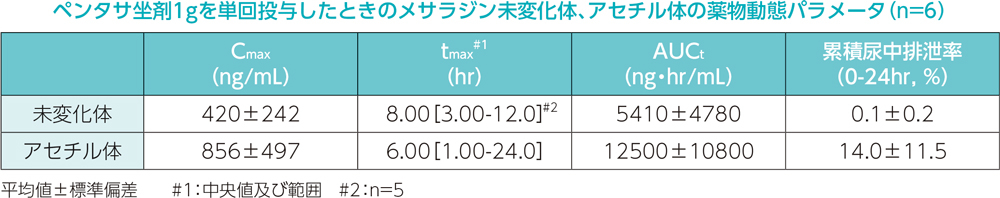
2. 併用投与試験(ペンタサ坐剤1gとペンタサ経口剤2000mg)
日本人健康成人男性6例を対象として、ペンタサ坐剤1g及びペンタサ経口剤(2000mg)の併用投与時の血漿中メサラジン未変化体及びアセチル体の濃度推移を下図に、また薬物動態パラメータを下表に示しました。
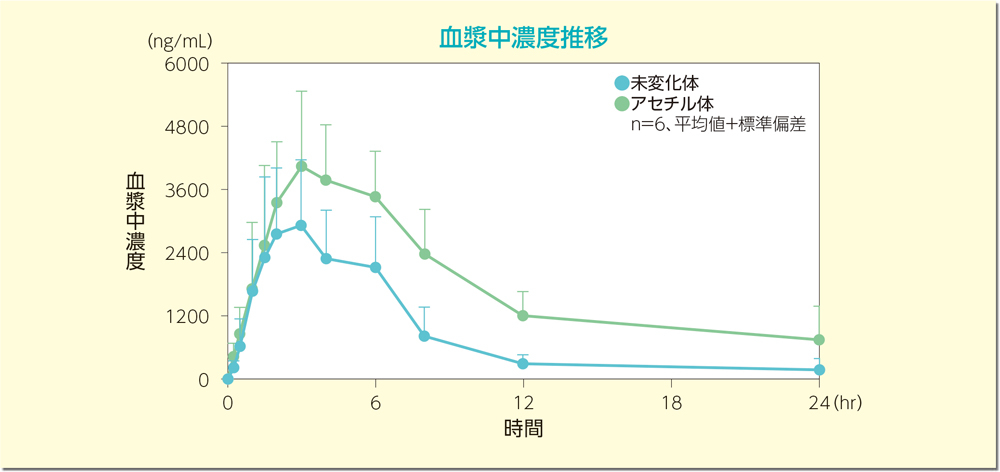
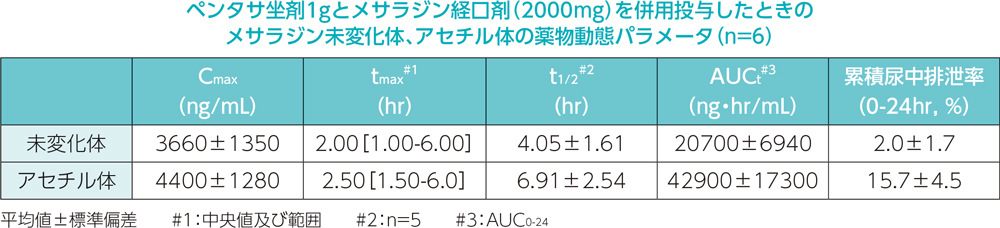
[参考]2)
- 7.
- 用法及び用量に関連する注意
- 7.1
- 本剤をメサラジン経口剤と併用する場合には、メサラジンとしての総投与量が増加することを考慮し、特に肝又は腎機能の低下している患者並びに高齢者等への投与に際しては、十分に注意すること。併用時に異常が認められた場合には、投与を中止する等の適切な処置を行うこと。[9.2.2、9.3.2、9.8参照]
ペンタサ®錠250mg・500mg
6. 用法及び用量(抜粋)
〈潰瘍性大腸炎〉
通常、成人にはメサラジンとして1日1,500mgを3回に分けて食後経口投与するが、寛解期には、必要に応じて1日1回の投与とすることができる。なお、年齢、症状により適宜増減するが、1日2,250mgを上限とする。
ただし、活動期には、必要に応じて1日4,000mgを2回に分けて投与することができる。
排泄1)
1. 単回投与試験
日本人健康成人男性6例を対象として、ペンタサ坐剤1gを空腹時に単回投与したとき、投与後24時間までの累積尿中排泄率は、メサラジン未変化体0.1%、アセチル体14.0%でした。
2. 併用投与試験(ペンタサ坐剤1gとペンタサ経口剤2000mg)
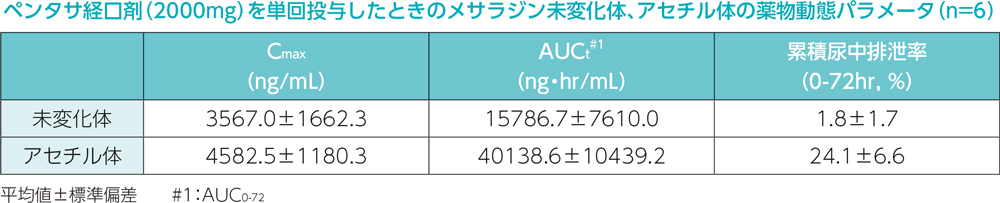
日本人健康成人男性6例を対象として、ペンタサ坐剤1g及びペンタサ経口剤(2000mg)の併用投与時の投与後24時間までの累積尿中排泄率は、メサラジン未変化体2.0%、アセチル体15.7%でした。2000mgのメサラジン経口剤投与時2)のメサラジン未変化体1.8%、アセチル体24.1%でした。
- 7.
- 用法及び用量に関連する注意
- 7.1
- 本剤をメサラジン経口剤と併用する場合には、メサラジンとしての総投与量が増加することを考慮し、特に肝又は腎機能の低下している患者並びに高齢者等への投与に際しては、十分に注意すること。併用時に異常が認められた場合には、投与を中止する等の適切な処置を行うこと。[9.2.2、9.3.2、9.8参照]
その他
153Smで標識したメサラジン坐剤1gを健康成人8例に直腸内投与したときの腸内での到達部位を検討した結果、8例全例で直腸部に限局していました(外国人データ)3)。
- 4.
-
効能又は効果
潰瘍性大腸炎(重症を除く)
- 5.
-
効能又は効果に関連する注意
直腸部の炎症性病変に対して使用すること。なお、本剤が腸内で到達する範囲は直腸部に限局されるため、S状結腸より口側の炎症には効果が期待できない。[16.8参照]
- 1) PS-SP臨床薬理試験<第Ⅰ相>ー健康成人男性を対象とした薬物動態の検討ー(社内資料:承認時評価資料)
- 2) ペンタサ錠250、同500 一変承認申請添付資料(社内資料)
- 3) Jacobsen B. A. et al:Scand J Gastroenterol 1991;26:374-378
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。


